Источник токов
Существует два типа электрохимических элементов: гальванические и электролитические. Гальваническая клетка использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции для выработки электроэнергии.
Электролитическая ячейка потребляет энергию от внешнего источника, используя ее, чтобы вызвать непредвиденную окислительно-восстановительную реакцию.
 Два типа ячеек
Два типа ячеек
Гальванический элемент, история создания которого официально началась в 18 веке, дал старт развития науки электротехники. Во время проведения экспериментов с электричеством в 1749 году Бенджамин Франклин впервые ввел термин «батарея» для описания связанных конденсаторов. Однако его устройство не стала первой ячейкой. Находки археологов «батареи Багдада» в 1936 году имеют возраст более 2000 лет, хотя точное назначение их до сих пор спорно.
Луиджи Гальвани в честь которого названа гальваническая ячейка, впервые описал «электричество животных» в 1780 году, когда пропускал ток через лягушку. В то время он не знал об этом, но его устройство работало по принципу батареи. Его современник Алессандро Вольта в честь которого названа «вольтовая ячейка» был убежден, что «животное электричество» исходило не от лягушки, а от чего-то другого, он много работал над этим и в 1800 году изобрел первую настоящую батарею — «вольтовую кучу».
 Александро Вольт
Александро Вольт
В 1836 году Джон Фредерик Даниэль, исследуя способы преодоления проблем вольтовой кучи создал свою ячейку. За этим открытием последовало создание ячейки Уильяма Роберта Гроува в 1844 году. Первая аккумуляторная батарея была изготовлена из свинцово-кислотного элемента в 1859 году компанией Gaston Plante, далее появились гравитационная ячейка Калло в 1860 и ячейка Лекланш Жоржа Лекланша в 1866 году.
До этого момента все батареи были мокрого типа. В 1887 году Карл Гасснер создал первую сухую батарею, изготовленную из углеродно-цинковой батареи. Никель-кадмиевая батарея была представлена в 1899 году Вальдмаром Юнгнером вместе с никель-железной батареей. Однако Юнгнер не смог запатентовать ее и в 1903 году изобретатель Томас Эдисон запатентовал свой слегка измененный дизайн.
Русский ученый-физик Василий Петров в 1802 году соорудил крупнейшую гальваническую батарею в мире, дающую напряжение 1500В. Для сооружения потребовалось около 4200 цилиндров из меди и цинка с диаметром 35.0 мм м толщиной 2.5 мм. Батарея была размещена в ящике из красного дерева, обработанного несколькими слоями различных смол. Опыты Петрова положили начало современной электрометаллургии в дуговых печах.
Обратите внимание! Крупный прорыв в гальваническом направлении источников тока произошел в 1955 году, когда Льюис Урри, сотрудник компании «Energizer», представил общую щелочную батарею. 1970-е годы привели к никель-водородной батарее, а 1980-е годы к никель-металлогидридной батарее. Литиевые батареи были впервые созданы еще в 1912 году, однако наиболее успешный тип, литий-ионный полимерный аккумулятор, используемый сегодня в большинстве портативных электронных устройств, был выпущен только в 1996 году
Литиевые батареи были впервые созданы еще в 1912 году, однако наиболее успешный тип, литий-ионный полимерный аккумулятор, используемый сегодня в большинстве портативных электронных устройств, был выпущен только в 1996 году.
Принцип работы гальванического элемента
Работа гальванического элемента осуществляется за счет движения электронов от одного металлического контакта к другому. Идет некое химическое превращение. Подробнее про термодинамику гальванического элемента и образование гальванического электричества читайте здесь.
Ответы на часто задаваемые вопросы
| Гальванический/ая | Разъяснение |
| Батарея | Источник энергии работающий за счет процессов, происходящих в ограниченном миниатюрном пространстве. В частности, энергия появляется, когда идет химическая реакция. |
| Элемент Вольта или Вольтов столб | Это энергетический элемент впервые созданный ученым по фамилии Вольт. |
| Процесс | Взаимодействие между химическими элементами в результате которого образуется электрический ток. |
| Разряд | Это завершение протекания химической реакции. То есть взаимодействия между веществами не будет.Гальванический разряд есть в игре Warframe. По сути это модификация, которая находится в большом дефиците. Ее используют для холодного оружия. Полярность V2. |
| Гальванический контакт | Это контакт между электродами и раствором. |
| Эффект | Появление разности между двумя контактами из 2-х типов металлов. Величина зависит от температуры и химии проводников. По сути это первый закон Вольта. |
| Соединение/связь/цепь | Объединение 2-х и более участков электрической цепи с источником тока. |
| Гальванический заряд | Наполнение батареи энергией. |
Гальваника – это протекание химических процессов с использование электрического тока. В ходе реакция сокращается количество растворенных катионов металла до такой степени что в конечном итоге они создают единое покрытие на металлическом электроде. В итоге предмет получается более прочным, исчезают небольшие вмятины и его вид становится более привлекательным.
Что это такое
В любом электрохимическом процессе электроны переходят из одного вещества в другое, что обусловлено ОВР. Восстановитель представляет собой вещество, которое теряет электроны и в процессе окисляется. Связанная энергия определяется разностью потенциалов между валентными электронами в атомах различных элементов.

Принцип работы
Гальванический элемент — это устройство, которое преобразует химическую энергию в электрическую, используя электрохимию, а в быту называется батареей.
В такой ячейке есть контейнер, в котором содержится раствор концентрированного сульфата меди (CuSO4), а внутри раствора вставлен медный стержень — катод. Внутри контейнера находится пористый сосуд, заполненный концентрированной серной кислота (H2SO4), в нее вставлен цинковый стержень — анод. Таким образом, когда провод соединяет медный и цинковый стержни, по нему начинает протекать электрический ток.
Дополнительная информация. Реакции окисления и восстановления разделяются на части, называемые полуреакциями. Внешняя цепь используется для проведения потока электронов между электродами гальванического элемента. Электроды изготавливают из любых проводящих материалов, таких как металлы, полупроводники, графит и даже полимеры.
История открытия химического электричества
Мало известен факт, что в 1752 году гальваническое электричество упоминалось Иоганном Георгом. Издание Исследование происхождения приятных и неприятных ощущений, выпущенное Берлинской академией наук, даже придавало явлению вполне правильное толкование. Опыт: серебряную и свинцовую пластины соединяли с одного конца, а противоположные с разных сторон прикладывались к языку. На рецепторах наблюдается вкус железного купороса. Читатели уже догадались, описанный способ проверки батареек часто использовали в СССР.

Химическое электричество
Объяснение явления: видимо, имеются некие частицы металла, раздражающие рецепторы языка. Частицы испускаются одной пластиной при соприкосновении. Причём один металл при этом растворяется. Собственно, налицо принцип действия гальванического элемента, где цинковая пластина постепенно исчезает, отдавая энергию химических связей электрическому току. Объяснение сделано за полвека до официального доклада Королевскому обществу Лондона Алессандро Вольта об открытии первого источника питания. Но, как происходит часто с открытиями, к примеру, электромагнитным взаимодействием, опыт остался незамечен широкой научной общественностью и не исследован должным образом.
Добавим, это оказалось связано с недавней отменой преследования за колдовство: немногие решались после печального опыта «ведьм» на изучение непонятных явлений. Иначе обстояло дело с Луиджи Гальвани, с 1775 года работающим на кафедре анатомии в Болонье. Его специализаций считались раздражители нервной системы, но светило оставил значимый след не в области физиологии. Ученик Беккарии активно занимался электричеством. Во второй половине 1780 года, как следует из воспоминаний учёного (1791, De Viribus Electricitatis in Motu Muscylary: Commentarii Bononiensi, том 7, стр. 363), в очередной раз производилось препарирование лягушки (опыты и потом длились долгие годы).
Примечательно, что необычное явление подмечено ассистентом, в точности, как с отклонением стрелки компаса проводом с электрическим током: открытие сделали лишь косвенно связанные с научными исследованиями люди. Наблюдение касалось подергиваний нижних конечностей лягушки. В ходе опыта ассистент задел внутренний бедренный нерв препарируемого животного, ножки дёрнулись. Рядом, на столе стоял электростатический генератор, на приборе проскочила искра. Луиджи Гальвани немедленно загорелся идеей повторить опыт. Что удалось. И опять на машине проскочила искра.
Опыты Луиджи Гальвани
Образовалась параллель связи с электричеством, и Гальвани возжелал узнать, станет ли на лягушку действовать подобным образом гроза. Оказалось, что природные катаклизмы не оказывают заметного воздействия. Лягушки, прикреплённые медными крючками за спинной мозг к железной ограде, дёргались вне зависимости от погодных условий. Опыты не удавалось реализовать со 100-процентной повторяемостью, атмосфера воздействия не оказывала. В итоге Гальвани нашёл сонм пар, составленных из разных металлов, которые при соприкосновении между собой и нервом вызывали подёргивание лапок у лягушки. Сегодня явление объясняют различной степенью электроотрицательности материалов. К примеру, известно, что нельзя алюминиевые пластины клепать медью, металлы составляют гальваническую пару с ярко выраженными свойствами.
Гальвани справедливо заметил, что образуется замкнутая электрическая цепь, предположил, что лягушка содержит животное электричество, разряжаемое подобно лейденской банке. Алессандро Вольта не принял объяснения. Внимательно изучив описание экспериментов, Вольта выдвинул объяснение, что ток возникает при объединении двух металлов, непосредственно или через электролит тела биологического существа. Причина возникновения тока кроется в материалах, а лягушка служит простым индикатором явления. Цитата Вольты из письма, адресованного редактору научного журнала:
Похожие файлы
Сумма напряжений на отдельных участках цепи при проходе по любому пути от входа к выходу равна полному приложенному напряжению. Последовательное соединение источников тока Разность потенциалов между положительным полюсом последнего источника и отрицательным полюсом первого будет равна сумме разностей потенциалов между полюсами каждого источника.
Диод полупроводниковый Резистор переменный Участок электроцепи, вдоль которого протекает один и тот же ток, называется ветвью. Все резисторы можно заменить одним эквивалентным резистором.
Последовательное соединение резисторов Когда несколько проводников или резисторов соединены последовательно рис. В любом узле, т. Это является разностью потенциалов на резисторе.
Распечатать Прежде чем разобраться в том, что такое схема электрической цепи, необходимо ввести несколько определений: Параметр электрической цепи — это число, которое устанавливает зависимость тока и напряжения на каком-то участке цепи на рисунке 1a r — это сопротивление, на рисунке 1б L — это индуктивность, на рисунке 1в C — это емкость. Примером параллельного соединения проводников служит соединение потребителей электрической энергии в квартире. Поэтому в вольтметре последовательно катушкам гальванометра включено некоторое сопротивление рис. Силы тока на всех проводниках будут одинаковыми.
Популярными стали схемы замещения пассивных и активных элементов во время работы. Если взять полупроводники , то среди них есть образцы с отрицательным и с положительным температурным коэффициентом сопротивления. Она целиком описывает процесс работы устройства, показывает все элементы цепи и то, как они взаимодействуют между собой.
Типы электрических цепей
Выводы зажимы источника и приемника энергии соединены между собой двумя проводами. Примерами таких нелинейных цепей, анализируемых как линейные, являются практически любые электронные устройства, работающие в линейном режиме и содержащие нелинейные активные и пассивные компоненты усилители, генераторы и др.
А величина напряжения также вычисляется по общим законам. При пользовании выключателем, на его контактах образуется искра. Поэтому в промышленных условиях целесообразно к электродвигателям параллельно подключать конденсаторы, которые будут компенсировать сопротивление с индуктивностью. Влияние схемы соединения на новогоднюю гирлянду После перегорания одной лампы в гирлянде можно определить вид схемы соединения. Пример подобной схемы электрической цепи приведен на следующем рисунке: Дополнительные материалы по теме: Схема электрической цепи.
Элемент электрической цепи — какое-либо устройство, которое является частью электрической цепи и выполняет отдельную задачу. Полная активная мощность, выделяемая активным двухполюсником,. К ним относятся транзисторы , микросхемы, тиристоры и много других видов, являющихся своеобразными электронными ключами. Часто ВАХ изображают графически в декартовых координатах. По этому признаку в электротехнике электрические цепи разделяют на контуры цепей.
Сборка электрической цепи и измерение силы тока в ней #ФизиканскиеЛьвы2018
Область использования
Электрохимия имеет множество важных применений, особенно в промышленности. Ее процессы используются для изготовления электрических батарей. Они имеют множество применений, включая:
- Топливный элемент преобразует химическую потенциальную энергию, получаемую при окислении топлива, например, газа, водорода, углеводородов, спиртов в электрическую энергию.
- Различные виды пьезозажигалок для газа.
- Электрические приборы, такие как мобильные телефоны.
- Цифровые камеры-литиевые.
- Слуховые аппараты (оксидно-серебряные).
- Электронные часы (ртутные/оксидно-серебряные).
- Военные источники тока (тепловые).
- Батарейки A, AA, AAA, D, C и другие.
Использование химических реакций для производства электричества в настоящее время является приоритетом для многих исследователей. Возможность адекватно использовать химические реакции в качестве источника энергии в значительной степени поможет решить проблемы загрязнения окружающей среды.
Устройство и принцип работы гальванического элемента

Металл, погруженный в раствор электролита, называется электродом.
Электроды — это система двух токопроводящих тел — проводников первого и второго рода.
К проводникам первого рода относятся металлы, сплавы, оксиды с металлической проводимостью, а также неметаллические материалы, в частности графит; носители заряда — электроны.
К проводникам второго рода относятся расплавы и растворы электролитов; носители заряда — ионы.
Устройство, состоящее из двух электродов, называется гальваническим элементом.
| Рис. 2. Схема медно-цинкового гальванического элемента |
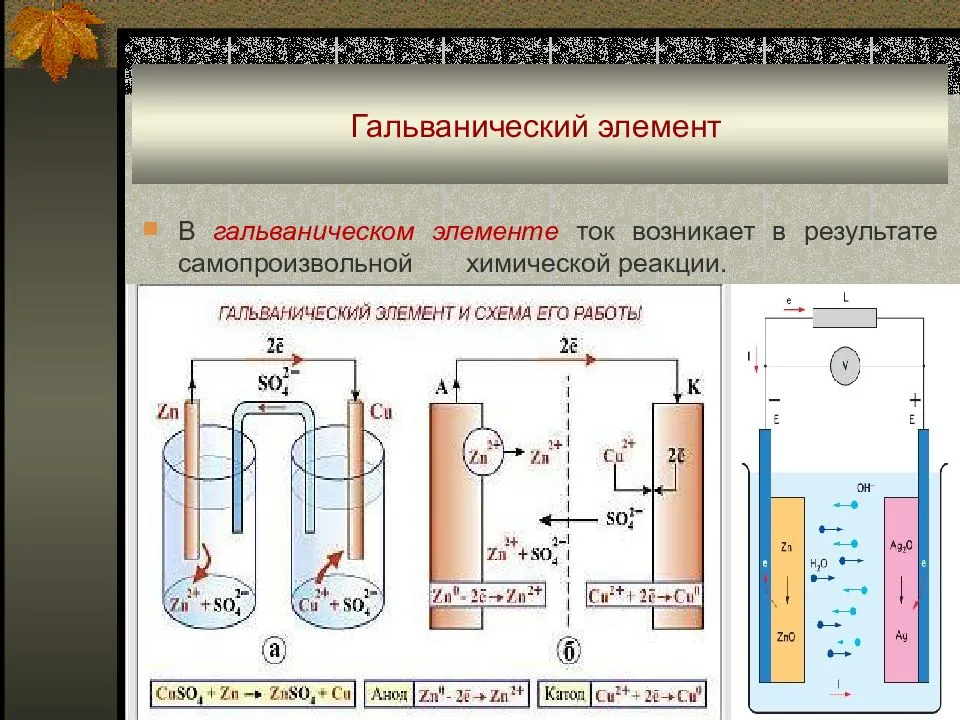
Рассмотрим гальванический элемент Якоби—Даниэля (схема приведена на рис. 2). Он состоит из цинковой пластины, погруженной в раствор сульфата цинка, и медной пластины, погруженной в раствор сульфата меди. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой.
В гальваническом элементе электрод, сделанный из более активного металла, т.е. металла, расположенного левее в ряду напряжений, называют анодом, а электрод, сделанный из менее активного металла — катодом.
На поверхности цинкового электрода (анода) возникает двойной электрический слой и устанавливается равновесие:
Zn0 – 2ē ←→ Zn2+.
В результате протекания этого процесса возникает электродный потенциал цинка.
На поверхности медного электрода (катода) также возникает двойной электрический слой и устанавливается равновесие:
Cu2+ + 2ē ←→ Cu0.
В результате возникает электродный потенциал меди.
Так как потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, то при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди. В результате этого процесса равновесие на цинковом электроде смещается вправо, поэтому в раствор перейдет дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместится влево и произойдет разряд ионов меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы или не растворится весь цинк или не высадится на медном электроде вся медь.
Итак, при работе гальванического элемента Якоби—Даниэля протекают следующие процессы:
1. Анодный процесс, процесс окисления:
Zn0 – 2ē → Zn2+.
2. Катодный процесс, процесс восстановления:
Cu2+ + 2ē → Cu0.
3. Движение электронов во внешней цепи.
4. Движение ионов в растворе: анионов SO42– к аноду, катионов Cu2+ к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Суммируя электродные реакции, получим:
Zn + Cu2+ = Zn2+ + Cu.
В результате протекании данной реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т.е. электрический ток. Поэтому суммарную химическую реакцию, протекающую в гальваническом элементе, называют токообразующей реакцией.
Электрический ток в гальваническом элементе возникает за счет окислительно-восстановительной реакции, протекающей так, что окислительные и восстановительные процессы оказываются пространственно разделенными: на отрицательном электроде (аноде) происходит процесс окисления, на положительном электроде (катоде) — процесс восстановления.
Необходимым условием работы гальванического элемента является разность потенциалов электродов. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. Она равна разности между потенциалом катода и потенциалом анода элемента:
ЭДС = Eк – Ea . (1)
ЭДС элемента считается положительной, если токообразующая реакция в данном направлении протекает самопроизвольно. Положительной ЭДС отвечает и определенный порядок в записи схемы элемента: записанный слева электрод должен быть отрицательным. Например, схема элемента Якоби—Даниэля записывается в виде:
Zn │ ZnSO4 ║ CuSO4 │ Cu .
Способ четвертый: батарейка в пивной банке
Анодом батарейки служит алюминиевый корпус банки из-под пива. Катодом – графитовый стержень.
- кусок пенопласта толщиной более 1 см;
- угольная крошка или пыль (можно применить то, что осталось от костра);
- вода и обычная поваренная соль;
- воск или парафин (можно использовать свечи).
От банки нужно отрезать верхнюю часть. Затем сделать кружок из пенопласта по размеру дна банки и вставить его внутрь, заранее сделав посередине отверстие для графитового стержня. Сам стержень вставляется в банку строго по центру, полость между ним и стенками заполняется угольной крошкой. Затем приготавливается водный раствор соли (на 500 мл воды 3 столовых ложки) и заливается в банку. Чтобы раствор не вылился, края банки заливаются воском или парафином.
Для подключения проводов к графитовым стержням можно использовать бельевые прищепки.
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ: САМОДЕЛЬНАЯ БАТАРЕЯ
Каждому из нас знакомы химические источники тока различных типов и форм. Но как это часто случается, мы редко задумываемся о том, как устроен этот совершенно привычный и обыденный предмет. А между тем, появление первых химических источников тока, положило начало превращению электричества из лабораторной диковинки в нашего повседневного помощника.
Правильное объяснение этому явлению смог дать другой итальянский ученый Алессандро Вольта. Он установил, что это явление связано с наличием двух разнородных металлов, соприкасающихся с электролитом, в роли которого выступала кровь лягушки, а сама лапка играла лишь роль чувствительного индикатора электрического тока . Опираясь на свои исследования Вольта в 1799г. создал первый химический источник тока. В этом устройстве Вольта использовал медный и цинковый электроды, погруженные в раствор серной кислоты.
Цинк бурно реагирует с кислотами. В раствор переходят не атомы цинка, а положительные ионы, так что в электроде остается избыток электронов, следовательно, цинковая пластина заряжается отрицательно. Вообще, большинство металлов при погружении в электролит заряжается отрицательно, на поверхности медной пластинки протекает подобный процесс. Но избыток отрицательных зарядов на медном электроде гораздо меньше, а значит, относительно цинкового электрода его потенциал получается более высоким. Если соединить внешним проводником медную и цинковую пластины, то электроны начнут перемещаться с цинковой пластины на медную, т.е. в цепи потечет электрический ток .
Часто напряжения, даваемого одним гальваническим элементом, недостаточно. Тогда их можно соединять последовательно в батареи.
Вообще изготовить химический источник тока совсем нетрудно: надо поместить в электролит две пластинки из разных металлов . Такие гальванические элементы возникают самопроизвольно. Например, намочил дождь крышу, покрытую оцинкованным железом, на железе наверняка имеются царапины, так, что и железо, и цинк вступили в контакт с водой, которая играет роль электролита. Цинк в такой паре начнёт активно разрушаться, а вот железо не пострадает, пока не разрушится весь цинк. Именно для этого и покрывают железо слоем цинка.
Нагляднее всего можно пронаблюдать гальваническую коррозию на примере контактов железа с цинком и медью в растворе соли. Железные скрепки были надеты на цинковую и медную пластины и погружены в раствор соли.
Через сутки скрепка, соединенная с медной пластиной, покрылась ржавчиной. В то время, как скрепка, бывшая в контакте с цинком, совершенно не пострадала.
Ученые составили электрохимический ряд напряжений металлов. Чем дальше друг от друга отстоят металлы в этом ряду, тем более высокое напряжение дает гальванический элемент, составленный из этих металлов. Так пара золото – литий теоретически может дать электродвижущую силу (ЭДС) 4,72 В. Но такая пара в водной среде работать не сможет – литий это щелочной металл, легко реагирующий с водой, а золото стоит слишком дорого для подобного применения.
На практике элемент Вольта обладает рядом серьёзных недостатков.
- Во-первых, электролитом ему служит весьма едкая жидкость – раствор серной кислоты. Жидкий электролит всегда представляет собой неудобство или даже опасность. Он может расплескаться, разлиться при повреждении корпуса.
- Во-вторых, на медном электроде такого элемента будет выделяться водород. Это явление называется поляризацией. По многим свойствам водород весьма близок к металлам, так что его пузырьки создадут дополнительную ЭДС поляризации, стремящейся вызвать ток противоположного направления . Кроме того, пузырьки газа не пропускают электрический ток, что тоже ведет к ослаблению тока. Поэтому приходится периодически встряхивать сосуд, удаляя пузырьки механически, или вводя в состав электролита специальные деполяризаторы.
- В третьих, в процессе работы гальванического элемента Вольта, цинковый электрод постепенно растворяется. Теоретически, когда гальванический элемент не используют, разрушение цинкового электрода должно прекратиться, но поскольку почти всегда в составе цинка есть примеси других металлов, они при соприкосновении с электролитом играют роль второго электрода, образуя короткозамкнутый элемент, что ведет к гальванической коррозии цинкового электрода . Для того, чтобы устранить этот недостаток, приходится использовать сверхчистый цинк или конструктивно предусматривать возможность извлечения цинкового электрода из электролита. Так что когда батарея не используется, электролит из нее следует сливать.
Но для демонстрационных целей всеми этими недостатками можно пренебречь, если заменить серную кислоту более безопасным электролитом.
Электрохимическая термодинамика реакций гальванических элементов
Электрохимические процессы в гальваническом элементе происходят из-за того, что реагенты с высокой свободной энергией (например, металлический Zn и гидратированная Cu2+ в ячейке Даниэля) преобразуются в продукты с меньшей энергией (металлическая Cu и гидратированный Zn2+ в этом примере). Разница в энергиях когезии решетки электродных металлов иногда является доминирующим энергетическим драйвером реакции, особенно в ячейке Даниэля. Металлические Zn, Cd, Li и Na, не стабилизированные d-орбитальный связь, имеют более высокие энергии когезии (т.е.они более слабо связаны), чем все переходные металлы, включая Cu, и поэтому полезны в качестве анодных металлов с высокой энергией.
Разница между энергиями ионизации металлов в воде это другой энергетический вклад, который может запустить реакцию в гальваническом элементе; это не важно в ячейке Даниэля, потому что энергии гидратированной Cu2+ и Zn2+ ионы оказываются похожими. Оба атомных переноса, например цинка с металлического электрода в раствор и перенос электронов от атомов металла или к ионам металлов играют важную роль в гальваническом элементе
Концентрационные ячейки, электроды и ионы которого сделаны из одного металла и которые двигаются за счет увеличения энтропии и уменьшения свободной энергии по мере выравнивания концентраций ионов, показывают, что электроотрицательность различие металлов не является движущей силой электрохимических процессов.
Гальванические элементы и батареи обычно используются в качестве источника электроэнергии. Энергию получают от растворения металла с высокой энергией когезии при осаждении металла с более низкой энергией и / или от осаждения ионов металла с высокой энергией, когда ионы с более низкой энергией переходят в раствор.
Количественно электрическая энергия, производимая гальваническим элементом, приблизительно равна стандартной разнице свободной энергии реагентов и продуктов, обозначенной как Δрграммо. В ячейке Даниэля большая часть электрической энергии Δрграммо = -213 кДж / моль можно отнести к разнице в -207 кДж / моль между энергиями когезии решеток Zn и Cu.
Типы гальванических элементов
Выделяют ряд батареек определенных типов.
Таблица гальванических элементов
| Тип | Напряжение | Основные плюсы |
| Литиевые | 3 V | Большая емкость, высокая сила тока. |
| Солевые батарейки или угольно – цинковые | 1.5 в | Самые дешевые. |
| Никельоксигидроксильные NiOOH | 1.6 вольт | Повышенный ток. Большая емкость. |
| Щелочные или алкалиновые | 1.6 V | Большая сила тока. Хороший объем. |
Более детальнее эта тема раскрыта в статье виды батареек!
Назначение гальванического элемента
Он предназначен для запуска электрической технике. Это могут быть:
- Часы.
- Пульты.
- Фонарики.
- Медицинское оборудование.
- Ноутбуки.
- Игрушки.
- Брелки.
- Телефоны.
- Лазерные указки.
- Калькуляторы.
И им подобные окружающие нас вещи.
История
В 1780 г. Луиджи Гальвани обнаружил, что когда два разных металла (например, медь и цинк) контактируют, а затем оба одновременно касаются двух разных частей мышцы лягушачьей ноги, замыкается цепь, лягушка сокращается.Он назвал это “животное электричество”. Нога лягушки, будучи датчиком электрического тока, была также электролит (говоря языком современной химии).
Через год после того, как Гальвани опубликовал свою работу (1790 г.), Алессандро Вольта показали, что в лягушке не было необходимости, используя вместо этого силовой детектор и пропитанную рассолом бумагу (в качестве электролита). (Ранее Вольта установил закон емкости C = QV с силовыми детекторами). В 1799 году Вольта изобрел гальваническую батарею, которая представляет собой группу гальванических элементов, каждая из которых состоит из металлического диска, слоя электролита и диска из другого металла. Он построил его полностью из небиологического материала, чтобы бросить вызов Гальвани (и последующему экспериментатору). Леопольдо Нобили) в пользу теории электричества животных в пользу его собственной теории контактного электричества металл-металл.Карло Маттеуччи в свою очередь построил батарея полностью из биологического материала в ответ Вольте. Взгляд Вольта на контактное электричество характеризовал каждый электрод числом, которое мы теперь назвали бы работой выхода электрода. Эта точка зрения игнорировала химические реакции на границах раздела электрод-электролит, которые включают ЧАС2 формирование на более благородном металле в куче Вольты.
Хотя Вольта не понимал принцип работы батареи или гальванического элемента, эти открытия проложили путь для электрических батарей; Ячейка Вольта получила название IEEE Milestone в 1999 году.
Примерно сорок лет спустя Фарадей (см. Законы электролиза Фарадея) показал, что гальванический элемент, который теперь часто называют гальваническим элементом, имел химическую природу. Фарадей ввел новую терминологию на язык химии: электрод (катод и анод), электролит, и ион (катион и анион). Таким образом, Гальвани ошибочно полагал, что источник электричества (или источник ЭДС, или место расположения ЭДС) находится в животном, Вольта ошибочно полагал, что это было в физических свойствах изолированных электродов, но Фарадей правильно определил источник ЭДС как химические реакции. на двух поверхностях раздела электрод-электролит. Авторитетная работа по интеллектуальной истории гальванической ячейки остается работой Оствальда.
Это было предложено Вильгельм Кениг в 1940 году объект, известный как Багдадский аккумулятор может представлять технологию гальванических элементов из древних Парфия. Было показано, что реплики, наполненные лимонной кислотой или виноградным соком, производят напряжение. Однако нет уверенности, что это было его предназначением – другие ученые отмечали, что он очень похож на сосуды, которые, как известно, использовались для хранения пергаментных свитков.
Рекомендации
- Кейтли, Джозеф Ф (1999). Дэниэл Селл. Джон Уайли и сыновья. С. 49–51. ISBN 978-0-7803-1193-0.
- Оствальд, Вильгельм (1980). Электрохимия: история и теория.
- Хотон, Брайан (2007) Скрытая история: потерянные цивилизации, тайные знания и древние тайны. Карьера Пресса. ISBN . стр. 129–132
- Ashcroft, N.W .; Мермин, Н. Д. (1976). Физика твердого тела. Форт-Уэрт, Техас: Харкорт.
- ^
- Аткинс, П; де Паула (2006). Физическая химия. J. (8-е изд.). Издательство Оксфордского университета. ISBN 978-0-19-870072-2. Глава 7, разделы «Равновесная электрохимия»
- Аткинс, П; де Паула (2006). Физическая химия. J. (8-е изд.). Издательство Оксфордского университета. ISBN 978-0-19-870072-2. Раздел 25.12 «Рабочие гальванические элементы»
Вариант 2
1. Трем парам одинаковых бумажных цилиндриков сообщены заряды. В какой паре цилиндрики оттолкнутся друг от друга?
1) № 1
2) № 2
3) № 3
2. Слева висящие шарики наэлектризованы и взаимодействуют с правыми заряженными шариками так, как показано на рисунке. Какой из правых шаров заряжен положительно?

1) № 1
2) № 2
3) № 3
3. Какое явление положено в основу действия электрометра? Что показывает этот физический прибор?
1) взаимодействие электрических зарядов; есть ли на теле, которым касаются его стержня, заряд и какова его относительная величина
2) на отталкивании друг от друга отрицательных зарядов; какого знака заряд находится на наэлектризованном теле
3) на отталкивании друг от друга положительных зарядов; относительную величину зарядов на телах
4. Незаряженных электроскопов касаются наэлектризованными так, как показано на рисунке, палочками. Как оказался заряженным электроскоп № 1? электроскоп № 2?
1) № 1 — отрицательно; № 2 — положительно
2) № 1 — положительно; № 2 — отрицательно
3) № 1 и № 2 — отрицательно
4) № 1 и № 2 — положительно
5. Заряженных электроскопов (положение их листочков обозначено на рисунке пунктиром) касаются наэлектризованными палочками, в результате чего их листочки расположились иначе. Какой электроскоп был заряжен положительно?
1) № 1
2) № 2
3) № 3
6. Какое из этих веществ — проводник электричества?
1) резина
2) серебро
3) шелк
7. В каких единицах измеряют электрический заряд?
1) Ваттах (Вт)
2) Джоулях (Дж)
3) Кулонах (Кл)
8. Какие частицы заключены в ядре атома?
1) протоны и электроны
2) протоны и нейтроны
3) нейтроны и электроны
9. В атоме находится 19 частиц, причем протонов в его ядре 6. Сколько в нем электронов и нейтронов?
1) 6; 7
2) 7; 6
3) 6; 6
10. При наличии 8 протонов в ядре каждого из трех атомов одного и того же вещества оказалось, что в первом из них 9 электронов, во втором — 8, в третьем — 7 электронов. Какой атом стал отрицательным ионом?
1) первый
2) второй
3) третий
11. Почему металлы — хорошие проводники электричества?
1) потому что в узлах их кристаллических решеток расположены ионы
2) потому что в них есть свободные электроны
3) потому что в атомах металлов много электронов
12. При каком условии в проводнике возникает электрический ток?
1) если в нем создано электрическое поле
2) если в нем много заряженных частиц
3) если частицы с электрическим зарядом приходят в движение
13. За счет какой энергии положительные и отрицательные заряды разделяются в гальваническом элементе?
1) механической
2) внутренней
3) энергии химических реакций
14. Что такое схема электрической цепи?
1) рисунок, на котором условно обозначены электроприборы
2) чертеж, на котором с помощью условных обозначений показаны соединения всех составных частей цепи
3) чертеж, показывающий, как соединены между собой проводниками потребители тока
15. Укажите, каким из этих условных обозначений изображают замыкающее цепь устройство.
1) № 1
2) № 2
3) № 3
16. Электрическая цепь состоит из аккумулятора, звонка и ключа. Какая из представленных здесь схем ей соответствует?

1) № 1
2) № 2
3) № 3
17. Движение каких заряженных частиц образует электрический ток в металлах? в проводящих растворах?
1) электронов; ионов
2) положительных ионов; отрицательных ионов
3) ядер атомов; любых ионов
18. Чем вызван выбор в качестве направления электрического тока направление от положительного полюса источника тока к отрицательному, т.е. противоположное действительному перемещению заряженных частиц (электронов) в обычных (металлических) проводниках?
1) историческим фактом: незнанием в то время, когда делался этот выбор, природы электрического тока
2) удобством нахождения этого направления
3) неизвестно
19. Какое действие электрического тока не проявляется в металлах?
1) магнитное
2) химическое
3) тепловое
20. Какой прибор предназначен для обнаружения в цепи электрического тока? Какое действие тока использовано в его устройстве?
1) гальванический элемент; химическое
2) электрометр; магнитное
3) гальванометр; магнитное




![Гальванический элементсодержание а также история [ править ]](https://ledsshop.ru/wp-content/uploads/8/6/9/869cabe3493aa8941671a371e9270670.jpeg)