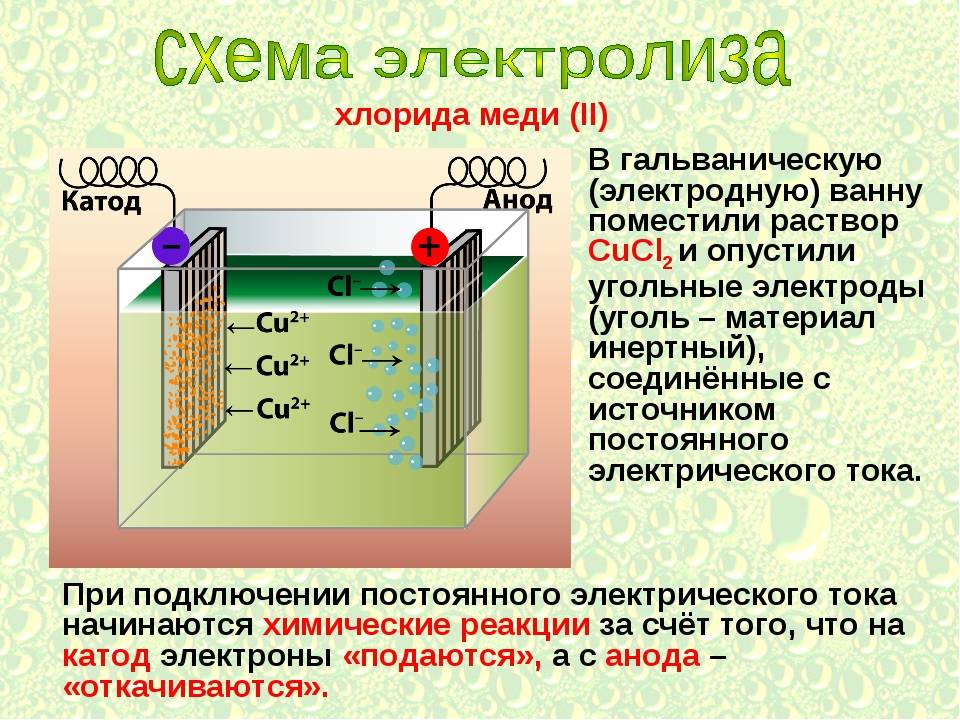
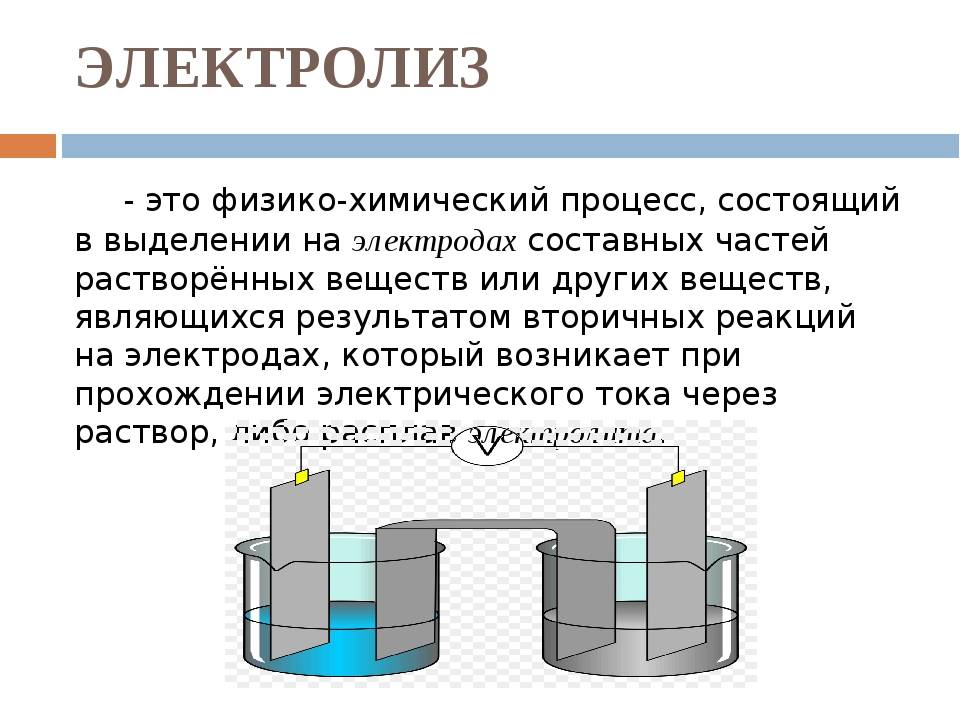
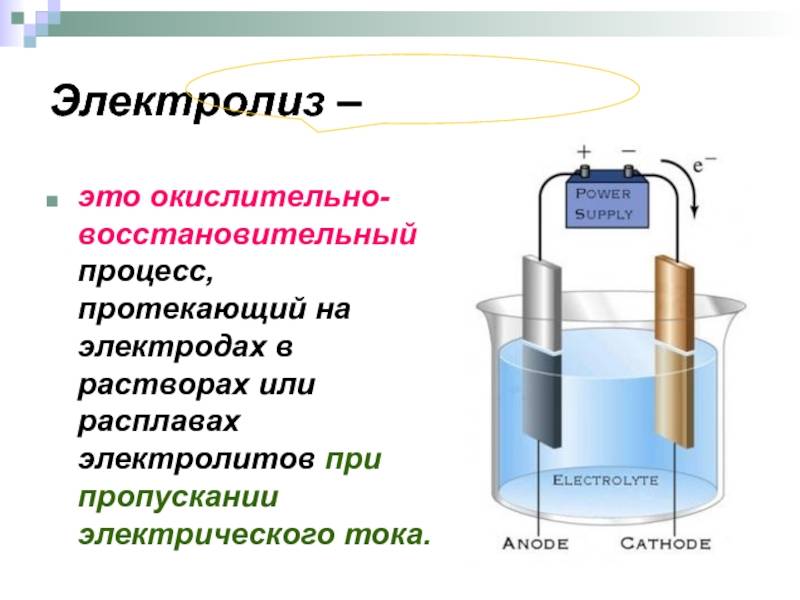
Факторы, влияющие на процесс электролиза
Процесс электролиза зависит от следующих факторов:
- Состав электролита. Значительное влияние оказывают различные примеси. Они подразделяются на 3 типа – катионы, анионы и органика. Вещества могут быть более или менее отрицательными, чем основной металл, что и мешает процессу. Среди органических примесей выделяются загрязнители (например масла) и ПАВ. Их концентрация имеет предельно допустимые значения.
- Плотность тока. В соответствии с законами Фарадея, масса осаждаемого вещества увеличивается с увеличением силы тока. Однако возникают неблагоприятные обстоятельства – концентрированная поляризация, повышенное напряжение, интенсивный разогрев электролита. С учетом этого существуют оптимальные значения плотности тока для каждого конкретного случая.
- рН электролита. Кислотность среды также выбирается с учетом металлов. Например оптимальное значение кислотности электролита для цинка – 140 г/куб.дм.
- Температура электролита. Она влияет неоднозначно. С увеличением температуры растет скорость электролиза, но повышается и активность примесей. Для каждого процесса есть оптимальная температура. Обычно она находится в пределах 38-45 градусов.
Электролиз расплавов
Электролизер
Если сравнить гальванолиз расплавов и растворов, то в расплавах все М: активные, малоактивные и неактивные, реагируют на процесс электризации одинаково.
Внимание! Вода при электролизе расплавов в электролите отсутствует. Поэтому осложнений, связанных с её вмешательством, не возникает
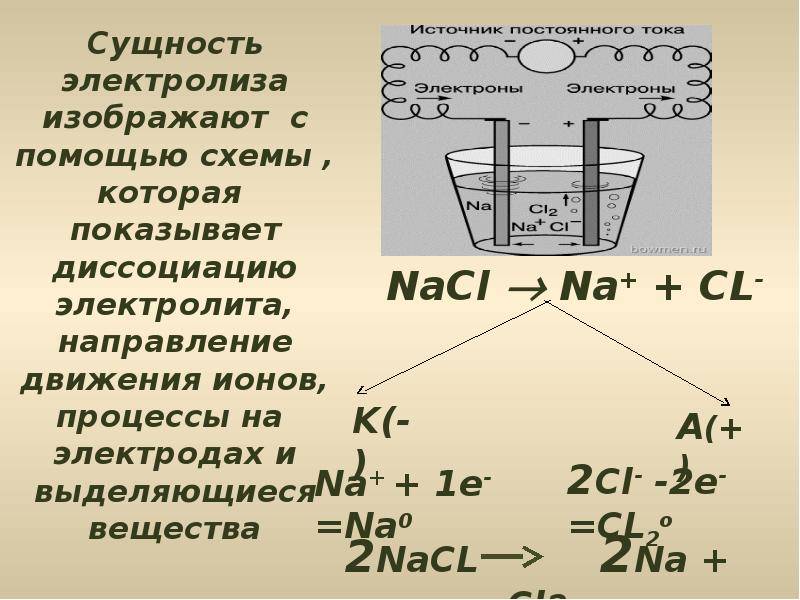
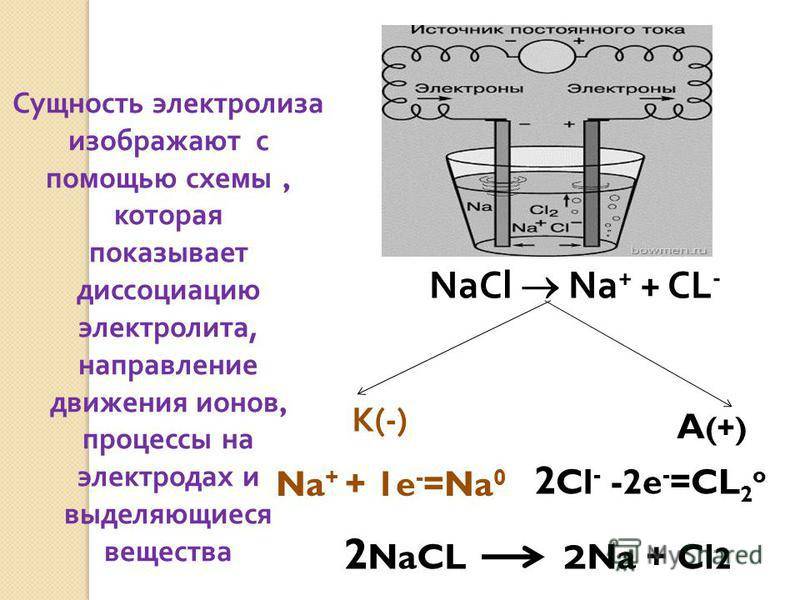
Описание такой реакции можно рассмотреть на примере расплава NaCl (хлористого натрия).
В этом случае на катоде происходит восстановление катионов Na:
Na+ + ē → Na0.
Анод вызывает окисление анионов Cl:
2Cl– – 2ē → Cl20.
Общее уравнение гальванолиза расплава NaCl будет иметь вид:
2Na+Cl– → 2Na0 + Cl20.

Схема электролиза расплава NaCl
Билет 39. Применение электролиза в технике
Электролиз находит широкое применение в технике.
Очистка или рафинирование металлов. Процесс происходит в электролитической ванне. Анодом служит металл, подлежащий очистке, катодом — тонкая пластинка из чистого металла, а электролитом — раствор соли данного металла, например, при рафинировании меди — раствор медного купороса. В загрязненных металлах могут содержаться ценные примеси. Так, в меди часто содержится никель и серебро. Для того чтобы на катоде выделялся только чистый металл, необходимо учитывать, что выделение каждого вещества начинается лишь при некоторой определенной разности потенциалов между электродами, называемой «потенциалом разложения». При надлежащем ее выборе из раствора медного купороса на катоде выделяется чистая медь, а примеси выпадают в виде осадка или переходят в раствор.
Электрометаллургия. Некоторые металлы, например, алюминий, получают методом электролиза из расплавленной руды. Электролитической ванной и одновременно катодом служит железный ящик с угольным полом, а анодом — угольные стержни. Температура руды (около 900 °С) поддерживается протекающим в ней током. Расплавленный алюминий опускается на дно ящика, откуда его через особое отверстие выпускают в формы для отливки.
Гальваностегия — электролитический способ покрытия металлических изделий слоем благородного или другого металла (золота, платины), не поддающегося окислению. Например, при никелировании предмета он сам служит катодом, кусок никеля — анодом. Пропуская через электролитическую ванну в течение некоторого времени электрический ток, покрывают предмет слоем никеля нужной толщины.
Гальванопластика, или электролитическое осаждение металла на поверхности предмета для воспроизведения его формы, была изобретена в 1837 г. русским ученым Б. С. Якоби, предложившим использовать электролиз для получения металлических отпечатков рельефных предметов (медалей, монет и др.). С предмета снимают слепок из воска или вырезают выпуклое изображение на деревянной доске и делают его проводящим, покрывая слоем графита. Затем опускают слепок или доску в качестве катода в электролит. Анодом служит кусок металла, используемого для осаждения. Этим способом изготовляют, например, типографские клише.
Электролитическим путем получают тяжелую воду (D2O), в которой атомы водорода заменены атомами его изотопа — дейтерия (D) с атомной массой 2.
Лабораторная работа №4.
1. Электролиз водного раствора иодида калия.
2KJ+2H2O электролиз J2+2H2+2KOH
Процесс на аноде.
А(+): 2J—2e-→J2
Процесс на катоде.
К(-): 2H2O+2e-→H2+2OH-
В результате электролиза наблюдаем:
При добавлении фенолфталеина в околокатодное пространство раствор становится малинового цвета, так как при восстановлении молекул воды образуются ионы ОН-, которые создают щелочную среду.
При добавлении раствора крахмала в околоанодное простанство наблюдаем появление синего окрашивания, которое является качественной реакцией на молекулярный йод, который образуется при окислении ионов J-.
2. Электролиз водного раствора сульфата натрия.
- Na2SO4+2H2O электролиз Na2SO4+2H2+O2↑
- 2H2O электролиз 2H2+O2↑
Процесс на аноде.
А(+): H2O-4e-→O2+4H+
Процесс на катоде.
К(-): 2H2O+2e-→H2+2OH-
При добавлении раствора универсального индикатора в околокатодное пространство наблюдаем синее окрашивание, так как при восстановлении молекул воды образуются ОН- ионы, которые дают щелочную среду.
При добавлении раствора универсального индикатора в околоанодное пространство наблюдаем красное окрашивание, так как при окислении молекул воды образуются H+ ионы, кторые дают кислую среду.
Сульфат натрия не принимает участия в электролизе. Протекает только электролиз воды.
3. Электролиз водного раствора сульфата меди (II).
2CuSO4+2H2Oэлектролиз 2Cu+O2+2H2SO4
Процесс на аноде.
А(+): H2O-4e-→O2+4H+
Процесс на катоде.
К(-): Cu2++2е-→Сu0
При электролизе раствора сульфата меди (II) на катоде наблюдаем выделение осадка красной меди.
В околоанодном пространстве выделяются пузырьки кислорода.
Вывод по проведенной работе:
Электролиз -окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного тока через систему, включающую электролит.
Электролиз растворов осложняется участием в электродных процессах ионов Н⁺ и ОН⁻. Кроме того, молекулы воды сами могут подвергаться электродному окислению или восстановлению.
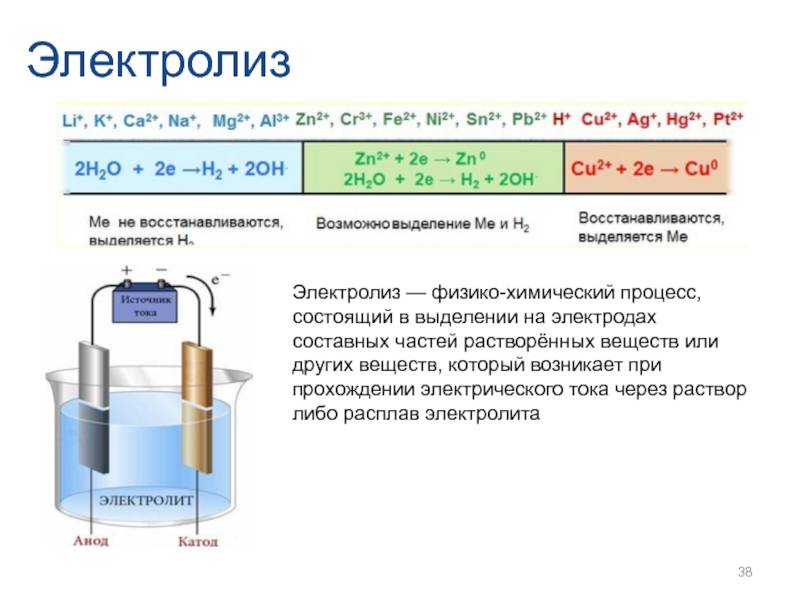
Катодные процессы в водных растворах при электролизе зависят от природы катиона.
Процессы, происходящие на катоде зависят от окислительной способности катиона металла:
- Li, K, Ca, Na, Mg, Al Mn, Zn, Fe, Ni, Sn, Pb H Cu, Hg, Ag, Pt, Au
- Меn⁺не восстанавливается (остаётся в растворе)
- 2 Н₂О+ 2ē = Н₂↑+2 ОН⁻ Меn⁺ + nē = Me°
- 2 H₂O + 2ē = H₂↑ + 2 OH⁻ Men⁺ + nē = Me°
Анодные процессы в водных растворах зависят от материала анода и природы аниона.
Процессы, происходящие на аноде
Безкислородные кислотные остатки
Кислородсодержащие кислотные остатки
- J⁻, Br⁻, S²⁻, Cl⁻ Окисление Аm⁻ (кроме F⁻)
- Аm⁻ – m ē = A° OH⁻, SO₄²⁻, NO₃⁻, F⁻
В щелочной среде:
- 4 ОН⁻ – 4 ē = О₂↑ + 2 Н₂О
- в кислой и нейтральной среде: 2 Н₂О – 4 ē = О₂↑ + 4 Н⁺
(Влияние материала анода не рассматриваем, так как в лабораторной работе влияние материала анода на протекание электролиза не рассматривается).
8. Приведите формулировку законов Фарадея? Каковы их математические выражения? Что называют числом Фарадея? Составьте электронные уравнения процессов, происходящих на инертных электродах при электролизе растворов CdCl2 и CdSO4.
Ответ:
Течение первичных анодных и катодных реакций во время протекания электролиза подчиняется законам Фарадея.
Первый закон Фарадея: масса вещества m, выделяемая на электроде электрическим током, пропорциональная количеству электричества Q, прошедшему через электролит:
- m = kQ, но Q =It (1)
- где I – сила тока, А; t – время пропускание тока, с.
- m = kIt (2)
k – коэффициент пропорциональности, равный количеству вещества, выделяемого при прохождении одного кулона (Кл) электричества (электрохимический эквивалент).
Второй закон Фарадея: массы различных веществ, выделенных одним и тем же количеством электричества, пропорциональных их химическим эквивалентам (Мэ):
Для выделения 1 грамма эквивалента вещества требуется пропустить через электролит одно и тоже количество электричества, равное приблизительно 96500 Кл (число Фарадея). Следовательно:
Подставив последнее уравнение в (2), получим формулу, объединяющую оба закона Фарадея.
(3)
Соотношение (3) используют в расчетах процессов при электролизе.
Электролиз водного раствора хлорида кадмия (II):
- CdCl2Cd2++2Cl-
- K(-):Cd2+, H2O А(+): Cl-, H2O
- Cd2++2e-→Cd 2Cl—2e-→Cl2
Суммарное уравнение электролиза:
CdCl2→Сd+Cl2
Электролиз водного раствора сульфата кадмия (II):
- CdSO4→ Cd2++SO42-
- K(-):Cd2+, H2O А(+):SO42-, H2O
- Cd2++2e-→Cd 2H2O-4e-→O2+4H+
Суммарное уравнение электролиза:
2CdSO4+2 H2O→2Cd+O2+2H2SO4
Уравнения
Диаграмма, показывающая общее химическое уравнение .
В чистой воде на отрицательно заряженном катоде происходит реакция восстановления , при которой электроны (e – ) с катода передаются катионам водорода с образованием газообразного водорода. Полуреакции , сбалансирован с кислотой, является:
- Восстановление на катоде: 2 H + ( водн. ) + 2e – → H 2 ( г )
На положительно заряженном аноде происходит реакция окисления , генерирующая газообразный кислород и отдающая электроны аноду для замыкания цепи:
- Окисление на аноде: 2 H 2 O ( l ) → O 2 ( г ) + 4 H + ( водн. ) + 4e –
Те же полуреакции также могут быть уравновешены основанием, указанным ниже. Не все полуреакции необходимо уравновешивать кислотой или основанием. Многие из них, например, окисление или восстановление воды, перечисленные здесь. Чтобы добавить половину реакции, обе они должны быть сбалансированы кислотой или основанием. Кислотно-сбалансированные реакции преобладают в кислых (с низким pH) растворах, тогда как реакции со сбалансированным основанием преобладают в основных (с высоким pH) растворах.
| Катод (восстановление): | 2 H 2 O ( л ) + 2e – | → | H 2 ( г ) + 2 OH – ( водн. ) |
| Анод (окисление): | 2 ОН – ( водн. ) | → | 1/2 O 2 ( г ) + H 2 O ( л ) + 2 e – |
Объединение любой пары половин реакции приводит к одинаковому общему разложению воды на кислород и водород:
- Общая реакция: 2 H 2 O ( л ) → 2 H 2 ( г ) + O 2 ( г ).
Таким образом, количество образующихся молекул водорода в два раза превышает количество молекул кислорода. Если предположить, что температура и давление для обоих газов одинаковы, полученный газообразный водород имеет, следовательно, вдвое больший объем, чем произведенный газообразный кислород. Количество электронов, проталкиваемых через воду, в два раза превышает количество генерируемых молекул водорода и в четыре раза больше количества генерируемых молекул кислорода.
Промышленное применение электролиза
Электролиз широко используется в следующих сферах промышленности:
- Выделение и очистка металлов.
- Получение алюминия, магния, натрия, кадмия.
- Получение щелочей, хлора, водорода.
- Очистка меди, никеля, свинца.
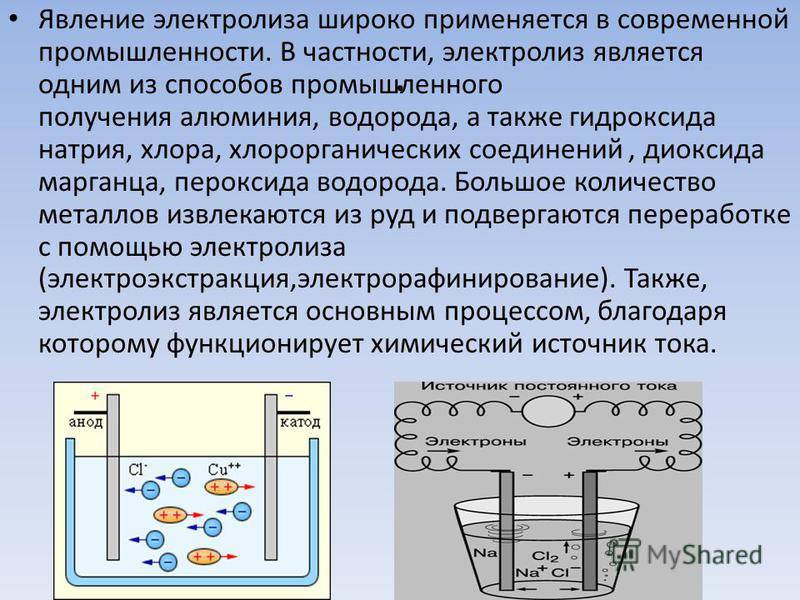
- Процессы напыления защитных покрытий с целью защиты металлов от коррозии.лектролиз (от греч. «лизис» – разложение, растворение, распад) – это совокупность физико-химических явлений на находящихся в жидкости электродах при прохождении электрического тока. Например, погрузив в воду два электрода и подключив их к источнику постоянного тока, мы обнаружим, что вокруг электродов выделяются пузырьки – это газы водород и кислород. При их образовании уменьшается масса воды, то есть она разлагается на входящие в её состав элементы.
Если электроды погружать не в воду, а в растворы или расплавы солей, кислот и щелочей, то можно наблюдать выделение других газов и даже твёрдых веществ, оседающих на поверхности электродов. По этой причине электролиз широко применяют в технике. Рассмотрим самые важные направления его применения. Но перед этим запомним, что электрод, присоединяемый к «+» источника тока, называют анодом, а электрод, присоединяемый к «–» источника тока, называют катодом.

Получение рафинированной меди.
Электрометаллургия
Электролитическим путём в промышленности получают многие металлы: алюминий, медь, магний, хром, титан и др. Например, для получения чистого алюминия в специальную металлическую ванну вливают расплавленную при 900 °С руду, содержащую алюминий в химически связанном виде (обычно в виде оксидов). В ванну опускают угольные стержни, которые служат анодами, а сама ванна – катодом. При прохождении тока через расплав на дне ванны выделяется жидкий алюминий, который сливают через отверстие внизу ванны.

Электрометаллургия.
Рафинирование (очистка) меди
Медь, применяемая в электро- и радиотехнике для изготовления проводников, должна быть чистой, поскольку примеси уменьшают электропроводность. Для очистки меди от примесей в электролитическую ванну заливают раствор сульфата меди II (устаревшее название – медный купорос) и опускают две пластины: анод – толстую пластину из неочищенной меди и катод – тонкий лист из чистой меди.
При пропускании электрического тока анод постепенно растворяется, примеси выпадают в осадок, а на катоде оседает чистая медь. Аналогичным способом получают и другие чистые металлы – никель, свинец, золото.
Гальваностегия
Для придания изделиям красивого внешнего вида, прочности или для предохранения от коррозии, их покрывают тонким слоем какого-либо металла: никеля, хрома и др. Для этого изделие тщательно очищают, обезжиривают и помещают как катод в электролитическую ванну, содержащую соль того металла, которым желают покрыть. Для более равномерного покрытия полезно применять две пластины в качестве анода, помещая изделие между ними.

Результат гальваностегии.
Гальванопластика
Это электролитическое осаждение металла на поверхности какого-либо предмета для воспроизведения его формы. Для этого с предмета сначала снимают слепок (из воска или гипса) и покрывают его токопроводящим слоем, например, слоем графита. Подготовленный таким способом предмет помещают в качестве катода в ванну с раствором соли соответствующего металла. При включении тока металл из электролита оседает на поверхности предмета. Гальванопластику используют для изготовления неограниченного числа точных копий того изделия, с которого был снят слепок.
Гальванополировка
Если резное металлическое изделие поместить в раствор электролита и включить ток, то наиболее сильное электрическое поле образуется у микроскопических выступов на поверхности этого изделия. Если оно подключено к «+» источника тока, то наиболее интенсивно ионы металла будут «вырываться» именно из выступов, и поверхность металла выровняется.
Будет интересно Что такое электрическое поле: объяснение простыми словам
Электрофорез
От греч. «форезис» – перенесение), это лечебная процедура. Электроды накладывают на тело человека. Между телом и электродом помещают бумагу или ткань, пропитанную электропроводящим лекарственным препаратом. При включении тока начинается движение заряженных частиц из бумаги или ткани в кожу, а затем в тело человека. Так происходит процесс ввода лекарств, скорость которого можно регулировать, изменяя силу тока. Электролиз применяют также и для синтеза различных неорганических и органических веществ; это изучается в отдельной науке – электрохимии.
Таблица изменения веществ с помощью электролиза
Усиление восстановительных способностей веществ:
Na+ | Mg2+ | Al3+ | Zn2+ | Fe3+ | Ni2+ | Sn2+ | Pb2+ | H+ | Cu2 | Ag+ |
Натрий | Магний | Алюминий | Цинк | Железо | Никель | Олово | Свинец | Водород | Медь | Серебро |
Усиление окислительных способностей веществ:
I- | Br- | Cl- | OH- | NO3- | CO32- | SO42-. |
Йодид (соли, образованные йодоводородной кислотой) | Бромид (соли, образованные бромоводородной кислотой) | Хлорид (соли, образованные соляной кислотой) | Гидроксид | Нитрат (соли, образованные азотной кислотой) | Карбонат (соли, образованные угольной кислотой) | Сульфат (соли, образованные серной кислотой) |
Катод (отрицательный) | Анод (положительный) |
Восстановление катионов после водорода | Окисление анионов кислот, не содержащих кислорода |
Восстановление катионов, имеющих среднюю активность | Окисление анионов оксокислот |
Восстановление наиболее активных катионов | Окисление анионов гидроксидов |
Восстановление катионов водорода |
Правила электролиза водных растворов

- Электролиз на катоде зависит только от положения металла в электрохимическом ряду напряжений:
- если катион электролита стоит левее алюминия (включительно), на катоде восстанавливается вода с выделением водорода, а катионы металла остаются в растворе:
2H2O+2e- = H2↑+2OH- (Li…Al) - если катион электролита стоит между алюминием и водородом, на катоде восстанавливаются и вода, и катионы металла;
Men++ne- = Me; 2H2O+2e- = H2↑+2OH- (Mn…Pb) - если катион электролита стоит правее водорода, на катоде восстанавливается только катионы металла:
Men++ne- = Me (Cu…Au) - если в растворе электролита находится несколько металлов, первыми восстанавливаются катионы металла, который в ряду напряжений стоит правее остальных.
- если катион электролита стоит левее алюминия (включительно), на катоде восстанавливается вода с выделением водорода, а катионы металла остаются в растворе:
- Электролиз на аноде зависит только от материала, из которого изготовлен анод:
- в случае растворимого анода (металлы, которые окисляются в процессе электролиза – железо, медь, цинк, серебро) – всегда идет процесс окисления металла анода:Me-ne- = Men+
- в случае нерастворимого анода (золото, платина, графит):
- идет процесс окисления аниона при электролизе растворов солей бескислородных кислот, за исключением фторидов:
Acm-me- = Ac - идет процесс окисления воды в остальных случаях (электролиз оксикислот и фторидов) – анион остается в растворе:
2H2O-4e- = 4H++O2↑ - при электролизе растворов щелочей окисляются гидроксид-ионы:
4OH–4e- = 2H2O+O2↑
- идет процесс окисления аниона при электролизе растворов солей бескислородных кислот, за исключением фторидов:
- восстановительная активность анионов уменьшается в ряду (соответственно увеличивается способность окисляться):
I-; Br-; S2-; Cl-; OH-; SO42-; NO3-; F-
Применение электролиза в технике
Электролиз находит широкое применение в технике.Очистка или рафинирование металлов
. Процесс происходит в электролитической ванне. Анодом служит металл, подлежащий очистке, катодом — тонкая пластинка из чистого металла, а электролитом — раствор соли данного металла, например, при рафинировании меди — раствор медного купороса. В загрязненных металлах могут содержаться ценные примеси. Так, в меди часто содержится никель и серебро. Для того чтобы на катоде выделялся только чистый металл, необходимо учитывать, что выделение каждого вещества начинается лишь при некоторой определенной разности потенциалов между электродами, называемой «потенциалом разложения». При надлежащем ее выборе из раствора медного купороса на катоде выделяется чистая медь, а примеси выпадают в виде осадка или переходят в раствор.
Электрометаллургия
. Некоторые металлы, например, алюминий, получают методом электролиза из расплавленной руды. Электролитической ванной и одновременно катодом служит железный ящик с угольным полом, а анодом — угольные стержни. Температура руды (около 900 °С) поддерживается протекающим в ней током. Расплавленный алюминий опускается на дно ящика, откуда его через особое отверстие выпускают в формы для отливки.
Гальваностегия
— электролитический способ покрытия металлических изделий слоем благородного или другого металла (золота, платины), не поддающегося окислению. Например, при никелировании предмета он сам служит катодом, кусок никеля — анодом. Пропуская через электролитическую ванну в течение некоторого времени электрический ток, покрывают предмет слоем никеля нужной толщины.
Гальванопластика
, или электролитическое осаждение металла на поверхности предмета для воспроизведения его формы, была изобретена в 1837 г. русским ученым Б. С. Якоби, предложившим использовать электролиз для получения металлических отпечатков рельефных предметов (медалей, монет и др.). С предмета снимают слепок из воска или вырезают выпуклое изображение на деревянной доске и делают его проводящим, покрывая слоем графита. Затем опускают слепок или доску в качестве катода в электролит. Анодом служит кусок металла, используемого для осаждения. Этим способом изготовляют, например, типографские клише.
Электролитическим путем получают тяжелую воду (D2O
), в которой атомы водорода заменены атомами его изотопа — дейтерия (D ) с атомной массой 2.
Промышленное использование
Процесс Холла-Эру для производства алюминия
- Электрометаллургии из алюминия , лития , натрия , калия , магния , кальция , а в некоторых случаях меди .
- Производство хлора и гидроксида натрия , называемое хлорно-щелочным процессом .
- Производство хлората натрия и хлората калия .
- Производство перфторированных органических соединений, таких как трифторуксусная кислота, методом электрофторирования .
- из рафинированной меди .
- Производство топлива, такого как кислород (для космических кораблей и атомных подводных лодок ), а также водорода .
- и чистка старых монет и других металлических предметов.
Производственные процессы
В производстве электролиз можно использовать для:
- Гальваника , при которой на материал подложки наносится тонкая пленка металла. Гальваника используется во многих отраслях промышленности как в функциональных, так и в декоративных целях, например в кузовах автомобилей и никелевых монетах.
- Электрохимическая обработка (ЭХМ), при которой электролитический катод используется в качестве инструмента для удаления материала путем анодного окисления с заготовки. ECM часто используется как метод удаления заусенцев или травления металлических поверхностей, таких как инструменты или ножи, с несмываемой меткой или логотипом.
Первый закон Фарадея
Установленный Фарадеем первый закон говорит о прямой пропорциональности между массой вещества, выделившейся в ходе электролиза, и величиной заряда, который прошел через электролит.

Правило подкреплено формулой m = k * q
, то есть произведение заряда вещества на его электрохимический эквивалент, что равняется его массе.
Проверка первого закона Фарадея происходит следующим образом:
- нужно взять три любых электролита, например, А, Б и В и пропустить ток через каждый;
- если вещества одни и те же, то массы выделившихся можно назвать Г, Г1 и Г2;
- при этом будет верным следующее равенство: Г= Г1+Г2.
Теоретическая часть
Электролиз – совокупность окислительно-восстановительных реакций, протекающих под действием постоянного электрического тока на электродах, погруженных в раствор или расплав электролита. При электролизе химическая реакция осуществляется за счет энергии электрического тока, подводимой извне. Электролиз проводят в особых приборах – электролизерах. Это сосуд с раствором или расплавом электролита и опущенными в него электродами из металла или графита. К электродам прикладывают разность потенциалов от внешнего источника постоянного тока. Катод отдает электроны частицам вещества в электролите и восстанавливает их. Анод отбирает электроны от частиц в электролите, окисляя их.

Электролиз расплавов оснований.
При электролизе процессы окисления и восстановления протекают на различных электродах – аноде и катоде. Анод – это электрод, на котором происходит процесс окисления. При электролизе анод заряжен положительно. Катод – это электрод, на котором происходит процесс восстановления. При электролизе катод заряжен отрицательно. На окислительно-восстановительные процессы, протекающие при электролизе, влияют различные факторы:
- Природа электролита и растворителя;
- Материал электродов;
- Режим электролиза (напряжение, сила тока, температура).
Будет интересно Все о законе Ома: простыми словами с примерами для «чайников»
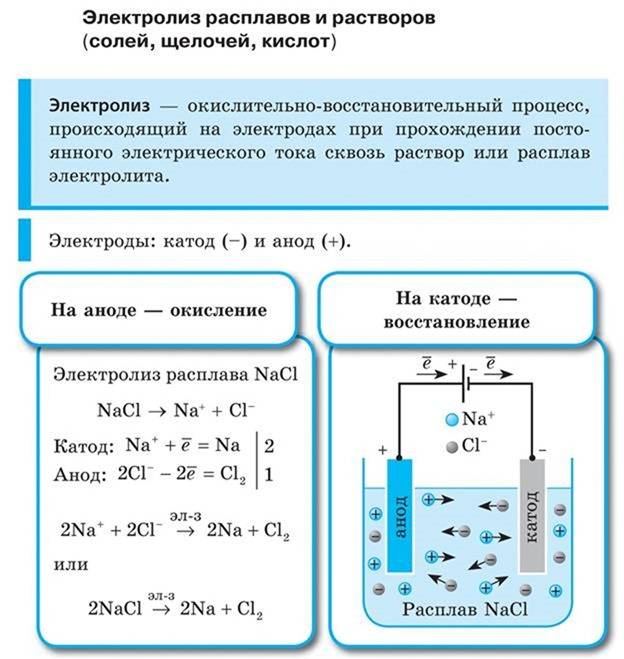
Различают 2 типа электролиза: электролиз расплава и электролиз растворов электролитов. Электролиз расплавов оксидов На катоде идет восстановление катионов металла: Men++ nē = Me0 , т.е. на катоде выделяется металл. На аноде окисляется кислород: O –2 –2ē = O2 Например, электролиз расплава оксида калия: 2K2O = 4K + O2 При изучении алюминия, способов получения металлов, надо знать электролиз оксида алюминия. Металлический алюминий получают электролизом раствора глинозема Al2O3 в расплавленном криолите Na2AlF6 при 960–970°С. Электролиз Al2O3 можно представить следующей схемой: в расплаве оксид алюминия диссоциирует: Al2O3= Al3++ AlO3 3– , на катоде восстанавливаются ионы Al3+ : Al3++3ē Al0 , на аноде окисляются ионы AlO3 3– : 4AlO3 3– – 12ē 2Al2O3 + 3O2. Суммарное уравнение процесса: 2Al2O3 4Al + 3O2. Жидкий алюминий собирается на дне электролизера.
Электролиз расплавов оснований
На катоде традиционно восстанавливается металл: Men+ +nē = Me0 На аноде будет окисляться кислород в составе гидроксид-группы: 4OH− −4ē =2H2O + O2 Электролиз расплавов солей 1. Электролиз расплава бескислородной соли: На катоде всегда восстанавливается металл: Men + nē = Me0 На аноде окисляется бескислородный анион: A n– – nē = A0 Например: Электролиз расплава NaCl: 2NaCl = 2Na + Cl2 2.Электролиз расплава кислородсодержащей соли (элемент аниона находится не в высшей степени окисления): На катоде всегда восстанавливается металл: Men++ nē = Me0 На аноде будет окисляться элемент аниона: SO3 2– – 2ē = SO3 0 Например, электролиз расплава сульфита натрия: Na2SO3 = 2Na + SO3 Сера S в сульфите имеет степень окисления +4, при электролизе она окисляется до +6 (SO3). 3.
Электролиз расплава кислородсодержащей соли (элемент аниона в высшей степени окисления): На катоде всегда восстанавливается металл: Men++ nē = Me0 На аноде: т.к
элемент уже в высшей степени окисления, то окисляться будет кислород, например: 2CO3 –2 – 4ē = 2CO2 + O2 Например, электролиз расплава карбоната натрия: 2Na2CO3 = 4Na + 2CO2+ O2 Важно понимать, что эти реакции не идут сами по себе. Их протекание возможно только при действии электрического тока
Электролиз растворов На катоде могут протекать следующие реакции восстановления.

Электролиз расплавов оснований.

Как работает электролиз.
Второй закон Фарадея
Электрохимические эквиваленты различных веществ пропорциональны их молярным массам и обратно пропорциональны числам, выражающим их химическую валентность.
Химическим эквивалентом иона называется отношение молярной массы A{\displaystyle A} иона к его валентности z{\displaystyle z}. Поэтому электрохимический эквивалент
- k = 1F⋅Az{\displaystyle k\ =\ {1 \over F}\cdot {A \over z}},
где F{\displaystyle F} — постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
- m=M⋅I⋅Δtn⋅F{\displaystyle m={\frac {M{\cdot }I{\cdot }{\Delta }t}{n{\cdot }F}}},
- где M{\displaystyle M} — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль
- I{\displaystyle I} — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А
- Δt{\displaystyle {\Delta }t} — время, в течение которого проводился электролиз, с
- F{\displaystyle F} — постоянная Фарадея, Кл·моль−1
- n{\displaystyle n} — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного)
- Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Особенности электролиза в растворах
Электролиз в водном растворе существенно отличается от расплава. Здесь имеют место 3 конкурирующих процесса: окисление воды с выделением кислорода, окисление аниона и анодное растворение металла. В процессе задействованы ионы воды, электролита и анода. Соответственно, на катоде может происходить восстановление водорода, катионов электролита и металла анода.

Возможность протекания указанных конкурирующих процессов зависит от величины электрических потенциалов системы. Протекать будет только тот процесс, который требует меньше внешней энергии. Следовательно, на катоде будут восстанавливаться катионы, имеющие максимальный электродный потенциал, а на аноде – окисляться анионы с наименьшим потенциалом. Электродный потенциал водорода принят за «0». Для примера, у калия он равен (-2,93 В), натрия – (-2,71 В), свинца (-0,13 В), а у серебра – (+0,8 В).
История
Устройство, изобретенное Иоганном Вильгельмом Риттером для разработки электролиза воды.
Ян Рудольф Дейман и Адриан Паэтс ван Трооствейк использовали в 1789 году электростатическую машину для производства электричества, которое разряжалось на золотых электродах в лейденской банке с водой. В 1800 году Алессандро Вольта изобрел гальваническую батарею , а несколько недель спустя английские ученые Уильям Николсон и Энтони Карлайл использовали ее для электролиза воды. В 1806 году Хамфри Дэви сообщил о результатах обширных экспериментов по электролизу дистиллированной воды, сделав вывод о том, что азотная кислота образуется на аноде из растворенного атмосферного азота. Он использовал высоковольтную батарею и нереактивные электроды и сосуды, такие как конусы золотых электродов, которые дублировались как сосуды, перекрытые влажным асбестом. Когда Зеноб Грамм изобрел машину Грамма в 1869 году, электролиз воды стал дешевым методом производства водорода. Метод промышленного синтеза водорода и кислорода электролизом был разработан Дмитрием Лачиновым в 1888 году.