Опыты Фарадея и электролиз
Течение электрического тока в жидкостях – это продукт процесса перемещения заряженных ионов. Проблемы, связанные с возникновение и распространением электротока в жидкостях, стали причиной изучения знаменитого ученого Майкла Фарадея. Он при помощи многочисленных практических исследований смог найти доказательства, что масса вещества, выделяемая в процессе электролиза, зависит от количества времени и электричества. При этом имеет значение время, в течение которого проводились эксперименты.
Также ученый смог выяснить, что в процессе электролиза при выделении определенного количества вещества необходимо одинаковое количество электрических зарядов. Это количество удалось точно установить и зафиксировать в постоянной величине, которая получила название числа Фарадея.
В жидкостях электрический ток имеет иные условия распространения. Он взаимодействует с молекулами воды. Они в значительной степени затрудняют все передвижения ионов, что не наблюдалось в опытах с использование обычного металлического проводника. Из этого следует, что образование тока при электролитических реакциях будет не столь большим. Однако при увеличении температуры раствора проводимость постепенно увеличивается. Это означает, что напряжение электрического тока растет. Также в процессе электролиза было замечено, что вероятность распада определенной молекулы на отрицательные или положительные заряды ионов увеличивается из-за большого числа молекул используемого вещества или растворителя. При насыщении раствора ионами сверх определенной нормы, происходит обратный процесс. Проводимость раствора вновь начинает снижаться.
В настоящее время процесс электролиза нашел свое применения во многих областях и сферах науки и на производстве. Промышленные предприятия его используют при получении или обработке металла. Электрохимические реакции участвуют в:
- электролизе солей;
- гальванике;
- полировке поверхностей;
- иных окислительно-восстановительных процессах.
Особенности электролиза растворов
В растворах электролитов, помимо самого вещества, присутствует вода. Под действием электрического тока водный раствор электролита разлагается.
Процессы, происходящие на катоде и аноде, различаются.
1. Процесс на катоде не зависит от материала, из которого он изготовлен. Однако, зависит от положения металлов в электрохимическом ряду напряжений.
2. Процесс на аноде зависит от материала, из которого состоит анод и от его природы.
а) Растворимый анод (Cu, Ag, Ni, Cd) подвергается Me => Men+ + ne
б)На не растворимом аноде (графит, платина) обычно окисляются анионы S-, J-, Br-, Cl-, OH- и молекулы H2O:
- 2J- => J2 + 2e;
- 4OH- => O2 + 2H2O + 4e;
- 2H2O => O2 + 4H+ + 4e
Рассмотрим примеры различных вариантов электролиза растворов:
1. Разложение бескислородной соли на нерастворимом электроде
Чтобы ознакомиться с этим вариантом электролиза, возьмем йодистый калий. Под действием тока ионы калия устремляются к катоду, а ионы йода к аноду.
KI → K+ + I-
Калий находится в диапазоне активности слева от алюминия, поэтому на катоде восстанавливаются молекулы воды и образуется атомарный водород.
Катод: 2H2O + 2e- → H2 + 2OH-
Процесс протекает на нерастворимом аноде и в состав соли входит бескислородный остаток, поэтому на аноде образуется йод.
Анод: 2I-— 2e- → I20
В результате можно создать общее уравнение электролиза:
2. Разложение бескислородной соли на растворимом электроде (медь)
Рассмотрим на примере хлорида натрия. Данная соль разлагается на ионы натрия и хлора, но следует учитывать материал анода. Медный анод сам подвергается окислению. На аноде выделяется чистая медь, и ионы меди переходят с анода на катод, где также осаждается медь. В итоге процесс можно представить следующими уравнениями реакций.
- NaCl → Na+ + Cl-
- Катод: Cu2+ + 2e- → Cu
- Анод: Cu — 2e- → Cu2+
В растворе концентрация хлорида натрия остается неизменной, поэтому составить общее уравнение реакции процесса не представляется возможным.
3. Разложение кислородосодержащей соли на нерастворимом (инертном) электроде
Возьмем для примера раствор нитрата калия. В процессе электролиза происходит распад на ионы калия и кислотного остатка.
KNO3 → K+ + NO3-
В ряду активности металлов калий находится левее алюминия, поэтому на катоде восстанавливаются молекулы воды и образуется газообразный водород.
Катод: 2H2O + 2e- → H2 + 2OH-
Молекулы воды окисляются на аноде и выделяется кислород.
Анод: 2H2O — 4e- → O2 + 4H+
В результате получаем общее уравнение электролиза:
2H2O → 2H2 + O2
4. Электролиз раствора щелочи на инертном электроде
В случае разложения щелочи в процесс электролиза включаются молекулы воды и гидроксид-ионы.
Ba(OH)2 → Ba2+ + 2OH-
Барий находится левее алюминия, поэтому на катоде происходит восстановление воды и выделение водорода.
Катод: 2H2O + 2e- → H2 + 2OH-
На аноде откладываются молекулы кислорода.
Анод: 4OH- — 4e- → O2 + 4H+
Получаем суммарное уравнение электролиза:
2H2O → 2H2 + O2
5. Электролиз раствора кислоты на инертном электроде
При разложении азотной кислоты под действием электрического тока в процесс вступают катионы водорода и молекула воды.
- HNO3 → H+ + NO3–
- Катод: 2H+ + 2e- → H2
- Анод: 2H2O — 4e- → O2 + 4H+
На катоде выделяется водород, на аноде – кислород. Получаем суммарное уравнение процесса:
2H2O → 2H2 + O2
Вопросы для самопроверки
1. Выберите верное продолжение фразы «катод — это…»:
Положительно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Положительно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
2. Продолжите фразу «электролиз — это…»:
ОВР с применением тока.
Реакция без изменения степеней окисления с применением тока.
ОВР с применением катализаторов.
Обменная реакция.
3. Как заряжен анион?
Положительно.
Отрицательно.
Нейтрально.
Не имеет заряда.
4. Чем отличается электролиз раствора от электролиза расплава?
Ничем.
В расплаве плавится твердое.
Присутствием молекул воды и продуктов ее диссоциации.
5. Если металл стоит в ряду активности металлов между алюминием и водородом, что выделится на катоде?
Этот металл.
Водород.
Металл и водород.
Оксид металла.
При электролиза водного раствора фторида лития что на аноде выделится?
Фтор.
Водород.
Кислород.
Вода.
Применение электролиза
А теперь самое главное: зачем вообще нужен электролиз? Рассмотрим применение этого вида ОВР:
С помощью электролиза расплавов природных соединений в металлургической промышленности получают активные металлы (калий, натрий, бериллий, кальций, барий). С помощью электролиза растворов солей — цинк, кадмий, кобальт и другие.
В химической промышленности электролиз используют для получения фтора, хлора, водорода, кислорода, щелочей, бертолетовой соли и других веществ.
Электролиз с растворимым анодом используют для нанесения металлических покрытий (из хрома, золота, никеля, серебра), что предохраняет металлические изделия от коррозии и придает им декоративный вид.
§ 2. Электролитическая диссоциация
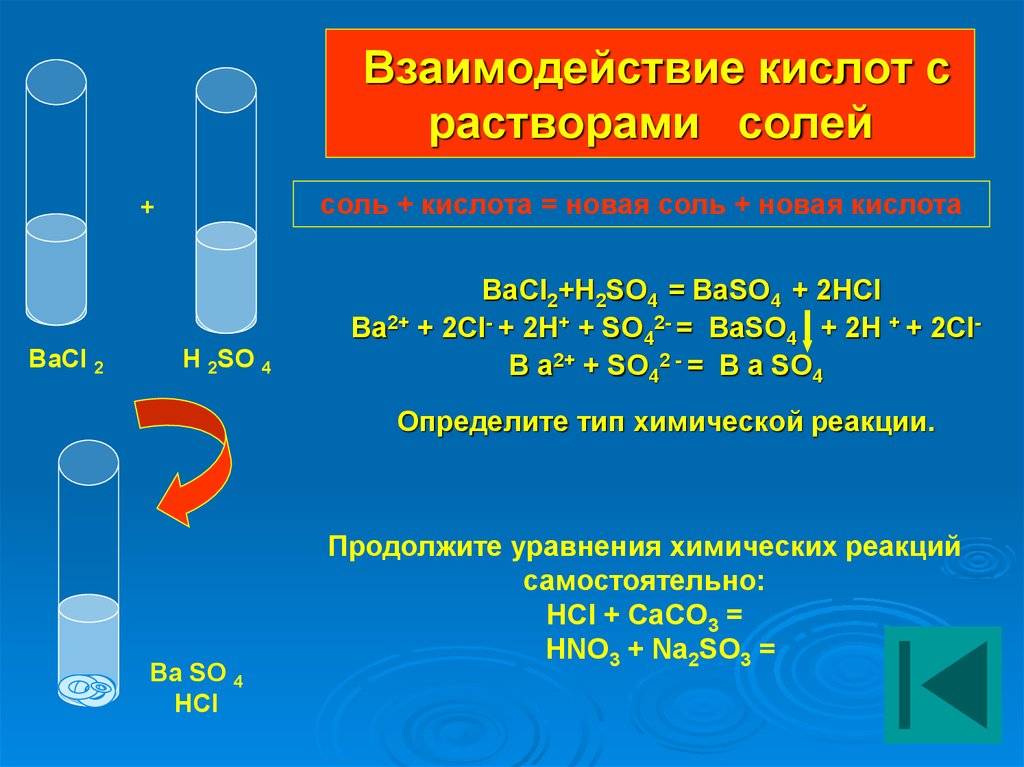
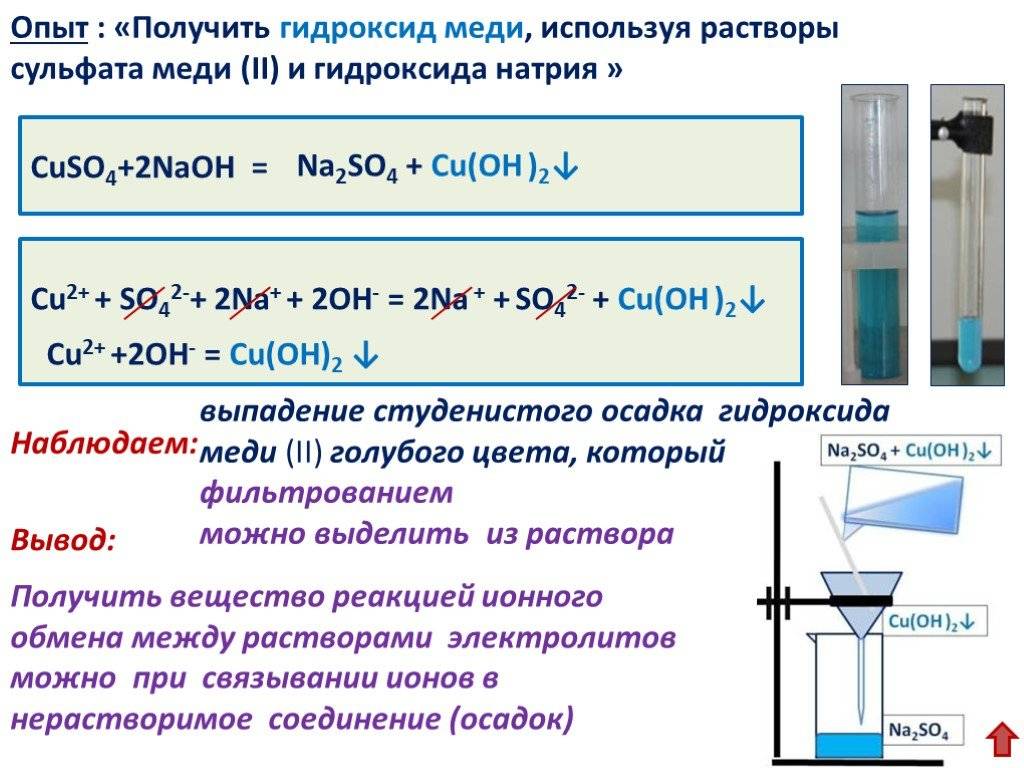
Почему водные растворы электролитов проводят электрический ток? Чтобы понять это, недостаточно знать, что электролиты, в отличие от неэлектролитов, состоят из ионов. Электрический ток – это движение заряженных частиц. Тело может проводить ток лишь в том случае, если в нем содержатся заряженные частицы, и эти частицы могут свободно перемещаться. Как вам известно из курса физики, в металлических проводниках такими частицами – переносчиками электрического тока – являются электроны. Какие же заряженные частицы содержатся в растворе электролита, например поваренной соли? В нем содержатся молекулы воды Н2О и, возможно, молекулы соли NaCl. Переносчиками тока не могут быть молекулы воды: ведь они не заряжены. Впрочем, мы и на опыте убедились, что чистая вода тока не проводит. Не заряжены и не могут служить переносчиками электрического тока и молекулы поваренной соли NaCl, хотя они и состоят из заряженных частичек – ионов Na+ и Сl-. Остается предположить, что при растворении в воде кристаллы поваренной соли распадаются на ионы, из которых они составлены.
В кристаллах поваренной соли ионы Na+ и Сl- сильно притягиваются друг к другу и не могут свободно перемещаться. Поэтому твердая соль не проводит электрического тока. При растворении же солей в воде ионы металла и кислотного остатка отрываются друг от друга и распределяются между молекулами воды. В растворе появляются свободно движущиеся заряженные частицы, и раствор становится электропроводным.
Щелочи тоже ионные соединения, состоящие из ионов металла и ионов гидроксила. Твердые щелочи, как и твердая поваренная, соль, не проводят электрического тока, потому что ионы в них не могут свободно перемещаться. При растворении щелочи под действием молекул воды распадаются на ионы, и раствор становится электропроводным.
В молекулах кислот связь между атомами водорода и кислотным остатком не ионная, а ковалентная. Однако электронные пары, связывающие атомы водорода с кислотным остатком, смещены в этих молекулах в сторону кислотного остатка.
Под влиянием молекул воды связь между водородом и кислотным остатком из полярной превращается в ионную, и молекулы кислоты распадаются в растворе на ионы, например молекулы соляной кислоты НСl на ионы водорода Н+ и хлора Cl-.
Распад электролита на ионы при растворении его в воде или расплавлении называют электролитической диссоциацией.
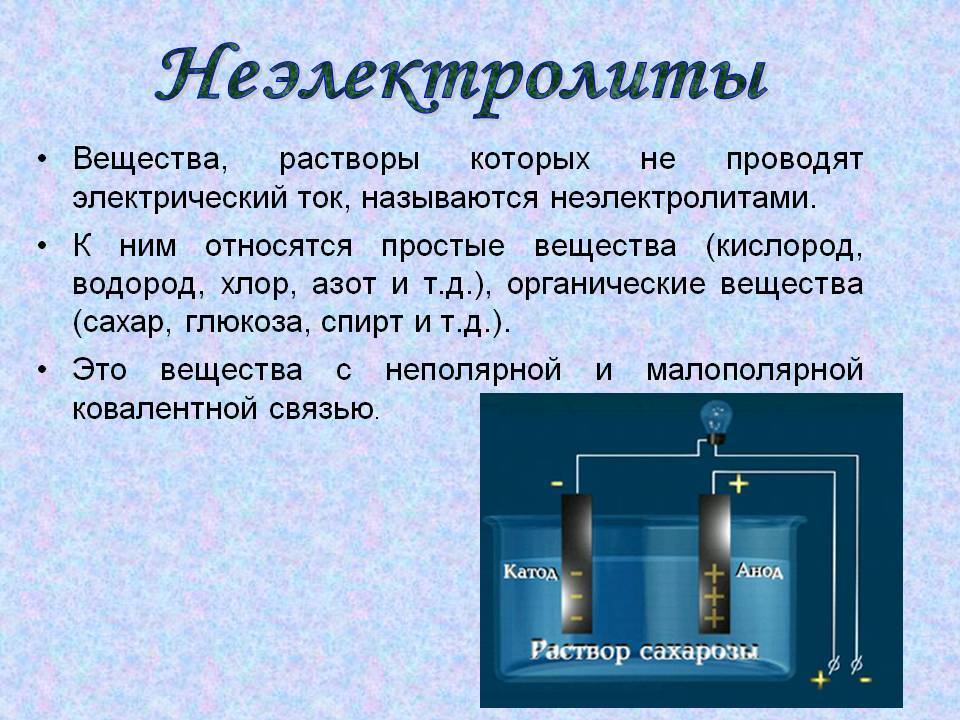
При растворении в воде или расплавлении соединений с ковалентными неполярными или малополярными связями, например сахара, происходит только распад его кристаллов на отдельные молекулы, ионов не образуется, и раствор или расплав сахара тока не проводит.
Теория, объясняющая особое поведение электролитов в расплавленном или растворенном состоянии распадом их на ионы, называется теорией электролитической диссоциации. Автор этой теории – шведский ученый Сванте Аррениус.
- Как объясняется электропроводность растворов электролитов?
- Какие вещества диссоциируют на ионы? Ответ свяжите с характером химической связи в них.
Электролиз расплава
Рассмотрим электролиз расплава пищевой соли — хлорида натрия. При сильном нагревании кристаллический твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы хлора и натрия, освободившиеся из кристаллической решетки, и проводит электрический ток.
К−: 2Na+ + 2e− = 2Na
А+: 2Cl− − 2e− = Cl2
Суммарное уравнение электролиза:
При опускании в расплав угольных (инертных) электродов, присоединенных к источнику тока, ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы — к положительно заряженному электроду (аноду) и отдают электроны.
Теперь давайте рассмотрим электролиз расплава гидроксида калия.
На катоде происходит восстановление калия за счет принятия электронов. А на аноде протекает более сложная реакция. Гидроксогруппы отдают свой электрон и становятся нейтральными, но такое состояние для них крайне невыгодно, так как неустойчиво, и они объединяются в группы, чтобы потом разложиться с выделением газообразного кислорода и воды
Итог электролиза расплава — металлический калий на катоде, газообразный кислород и пары воды на аноде.
Электролиз раствора
Основным отличием водного раствора от расплава является присутствие молекул воды и ионов H+ и OH- как продуктов диссоциации воды. В связи с этим возле катода и анода скапливаются ионы, которые конкурируют как друг с другом, так и с молекулами воды. Рассмотрим электролиз на примере водного раствора KF:
К−: 4H2O + 4e− = 2H2 + 4OH−
А+: 2H2O − 4e− = O2 + 4H+
Суммарное уравнение электролиза:
Как видно, ни калий, ни фтор не фигурируют в продуктах электролиза. Почему так происходит?
Наиболее активные металлы — сильные восстановители. Калий — как раз такой металл, поэтому обратный процесс восстановления активных металлов из соединений осуществить сложно. При электролизе водных растворов солей активных металлов на катоде протекает восстановление не катионов этих металлов, а воды с образованием водорода.
Разберем порядок восстановления катионов металлов на катоде в зависимости от их активности.
Последовательность разрядки катионов зависит от положения металла в электрохимическом ряду напряжения.
Если у катода накапливаются молекулы воды и катионы металла, который находится в ряду напряжения после водорода, то восстанавливаются ионы металла.
Если у катода накапливаются молекулы воды и катионы металла, который стоит в начале ряда напряжения от лития до алюминия включительно, то восстанавливаются ионы водорода из молекул воды. Катионы металла не восстанавливаются, остаются в растворе.
Если у катода накапливаются молекулы воды и катионы металла, который расположен в ряду напряжения между алюминием и водородом, то восстанавливаются и ионы металла, и частично ионы водорода из молекул воды.
Если в растворе находится смесь катионов разных металлов, то сначала восстанавливаются катионы менее активного металла.
При электролизе раствора кислоты на катоде восстанавливаются катионы водорода до газообразного водорода.
Для удобства мы собрали информацию об электролизе в таблице:
Теперь разберемся, что происходит с анионами в водных растворах при электролизе. Для начала познакомимся с последовательностью восстановления анионов на аноде:
Чем меньше выражена восстановительная активность, тем хуже анионы могут окисляться на аноде. К тому же процесс на аноде зависит от материала анода и от природы аниона.
Если анод инертный или нерастворимый, то на нем протекают следующие реакции:
При электролизе растворов солей бескислородных кислот (кроме фторидов!), на аноде происходит процесс окисления аниона.
При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде выделяется газообразный кислород вследствие окисления молекул воды. Анион при этом не окисляется, оставаясь в растворе.
При электролизе растворов щелочей происходит окисление гидроксид-ионов.
Если анод растворимый, то на нем всегда происходит окисление металла анода — независимо от природы аниона.
Исключением является электролиз солей карбоновых кислот. Таблица выше не описывает происходящее на аноде. Давайте рассмотрим, что же там происходит.
В результате электролиза водных растворов солей щелочных металлов карбоновых кислот происходит образование углеводородов вследствие рекомбинации углеводородных радикалов.
В общем виде электролиз солей карбоновых кислот можно записать так:
На катоде образуется газообразный водород, а на аноде — углекислый газ, углеводород, полученный удвоением радикала. В катодном пространстве накапливается щелочь.
В случае разделения катодного и анодного пространства углекислый газ реагирует со щелочью с образованием гидрокарбоната.



![§ 2. электролитическая диссоциация [1971 ходаков ю.в., эпштейн д.а., глориозов п.а. - неорганическая химия. учебник для 9 класса]](https://ledsshop.ru/wp-content/uploads/1/a/4/1a405323c6e6538759d2e48bf95cb819.jpeg)





![§ 2. электролитическая диссоциация [1971 ходаков ю.в., эпштейн д.а., глориозов п.а. - неорганическая химия. учебник для 9 класса]](https://ledsshop.ru/wp-content/uploads/7/4/6/746548447289729feda1f50b5c20cbe8.jpeg)




![§ 2. электролитическая диссоциация [1971 ходаков ю.в., эпштейн д.а., глориозов п.а. - неорганическая химия. учебник для 9 класса]](https://ledsshop.ru/wp-content/uploads/3/3/a/33aac14e675728d73dae43816c395b66.png)




![§ 2. электролитическая диссоциация [1971 ходаков ю.в., эпштейн д.а., глориозов п.а. - неорганическая химия. учебник для 9 класса]](https://ledsshop.ru/wp-content/uploads/9/5/9/95907aebe7c031fb8c2ed0a36efea577.jpeg)


![§ 2. электролитическая диссоциация [1971 ходаков ю.в., эпштейн д.а., глориозов п.а. - неорганическая химия. учебник для 9 класса]](https://ledsshop.ru/wp-content/uploads/0/1/2/012230e45158d6fee1ec17cb6f20b173.jpeg)

![§ 2. электролитическая диссоциация [1971 ходаков ю.в., эпштейн д.а., глориозов п.а. - неорганическая химия. учебник для 9 класса]](https://ledsshop.ru/wp-content/uploads/0/3/6/036e5ef0780ef3bc994a8722333cef89.jpeg)






