Электролиз расплава
Рассмотрим электролиз расплава пищевой соли — хлорида натрия. При сильном нагревании кристаллический твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы хлора и натрия, освободившиеся из кристаллической решетки, и проводит электрический ток.
К−: 2Na+ + 2e− = 2Na
А+: 2Cl− − 2e− = Cl2
Суммарное уравнение электролиза:
При опускании в расплав угольных (инертных) электродов, присоединенных к источнику тока, ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы — к положительно заряженному электроду (аноду) и отдают электроны.
Теперь давайте рассмотрим электролиз расплава гидроксида калия.
На катоде происходит восстановление калия за счет принятия электронов. А на аноде протекает более сложная реакция. Гидроксогруппы отдают свой электрон и становятся нейтральными, но такое состояние для них крайне невыгодно, так как неустойчиво, и они объединяются в группы, чтобы потом разложиться с выделением газообразного кислорода и воды
Итог электролиза расплава — металлический калий на катоде, газообразный кислород и пары воды на аноде.
Сопротивление конденсатора.
Замкнем цепь. Конденсатор начал заряжаться и сразу стал источником тока, напряжения, Э. Д. С.. На рисунке видно что Э. Д. С. конденсатора направлена против заряжающего его источника тока.
Противодействие электродвижущей силы заряжаемого конденсатора заряду этого конденсатора называется емкостным сопротивлением.
Вся энергия затрачиваемая источником тока на преодоление емкостного сопротивления превращается в энергию электрического поля конденсатора. Когда конденсатор будет разряжаться вся энергия электрического поля вернется обратно в цепь в виде энергии электрического тока. Таким образом емкостное сопротивление является реактивным, т.е. не вызывающим безвозвратных потерь энергии.
Почему постоянный ток не проходит через конденсатор, а переменный ток проходит?
Включим цепь постоянного тока. Лампа вспыхнет и погаснет, почему? Потому что в цепи прошел ток заряда конденсатора. Как только конденсатор зарядится до напряжения батареи ток в цепи прекратится.
А теперь замкнем цепь переменного тока. В I четверти периода напряжение на генераторе возрастает от 0 до максимума. В цепи идет ток заряда конденсатора. Во II четверти периода напряжение на генераторе убывает до нуля. Конденсатор разряжается через генератор. После этого конденсатор вновь заряжается и разряжается. Таким образом в цепи идут токи заряда и разряда конденсатора. Лампочка будет гореть постоянно.
В цепи с конденсатором ток проходит во всей замкнутой цепи, в том числе и в диэлектрике конденсатора. В заряжающемся конденсаторе образуется электрическое поле которое поляризует диэлектрик. Поляризация это вращение электронов в атомах на вытянутых орбитах.
Одновременная поляризация огромного количества атомов образует ток, называемый током смещения.
Таким образом в проводах идет ток и в диэлектрике причем одинаковой величины.
Емкостное сопротивление конденсатора определяется по формуле
Рассматривая график делаем вывод: ток в цепи с чисто емкостным сопротивлением опережает напряжение на 90 0 .
Возникает вопрос каким образом ток в цепи может опережать напряжение на генераторе? В цепи идет ток от двух источников тока поочередно, от генератора и от конденсатора. Когда напряжение на генераторе равно нулю ток в цепи максимален. Это ток разряда конденсатора.
Вопросы для самопроверки
1. Выберите верное продолжение фразы «катод — это…»:
Положительно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Положительно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
2. Продолжите фразу «электролиз — это…»:
ОВР с применением тока.
Реакция без изменения степеней окисления с применением тока.
ОВР с применением катализаторов.
Обменная реакция.
3. Как заряжен анион?
Положительно.
Отрицательно.
Нейтрально.
Не имеет заряда.
4. Чем отличается электролиз раствора от электролиза расплава?
Ничем.
В расплаве плавится твердое.
Присутствием молекул воды и продуктов ее диссоциации.
5. Если металл стоит в ряду активности металлов между алюминием и водородом, что выделится на катоде?
Этот металл.
Водород.
Металл и водород.
Оксид металла.
При электролиза водного раствора фторида лития что на аноде выделится?
Фтор.
Водород.
Кислород.
Вода.
Электролитическая диссоциация
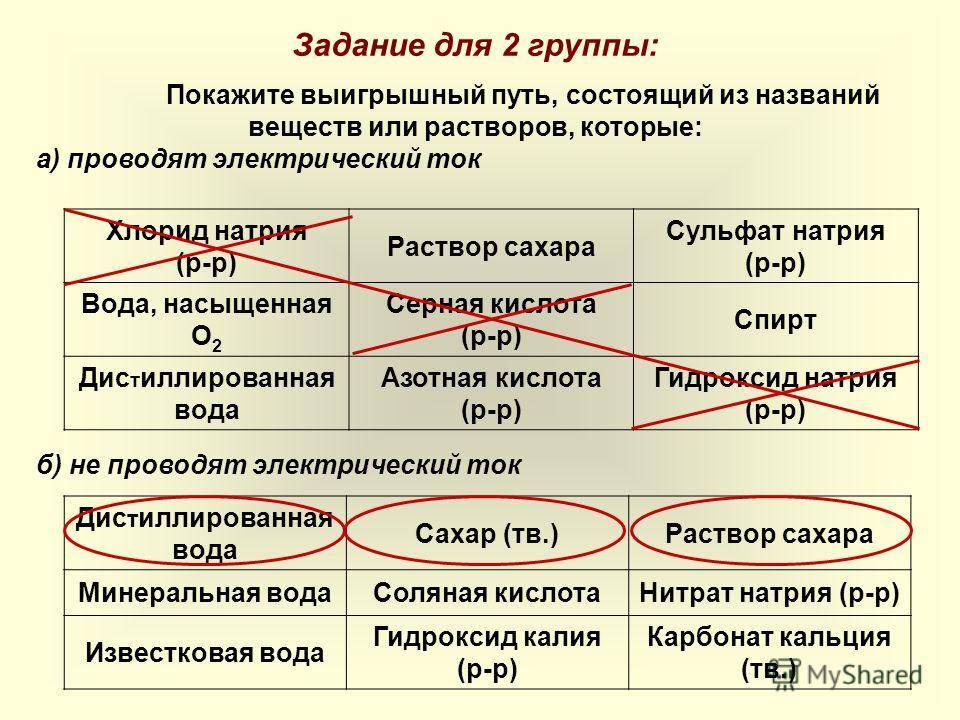
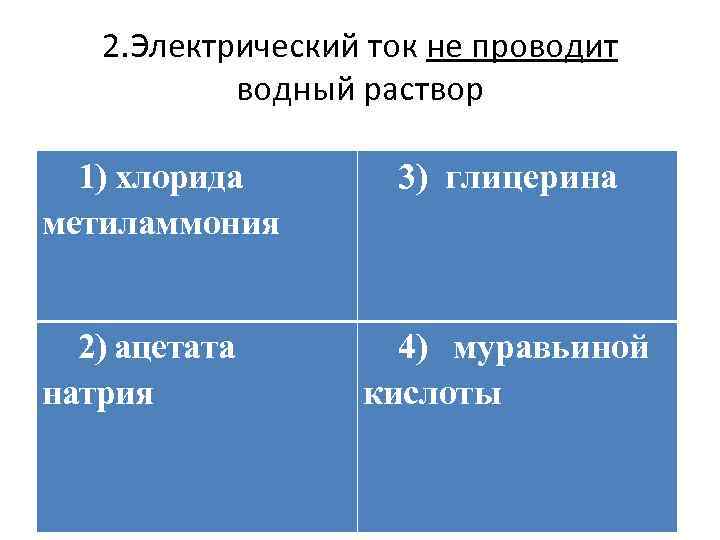
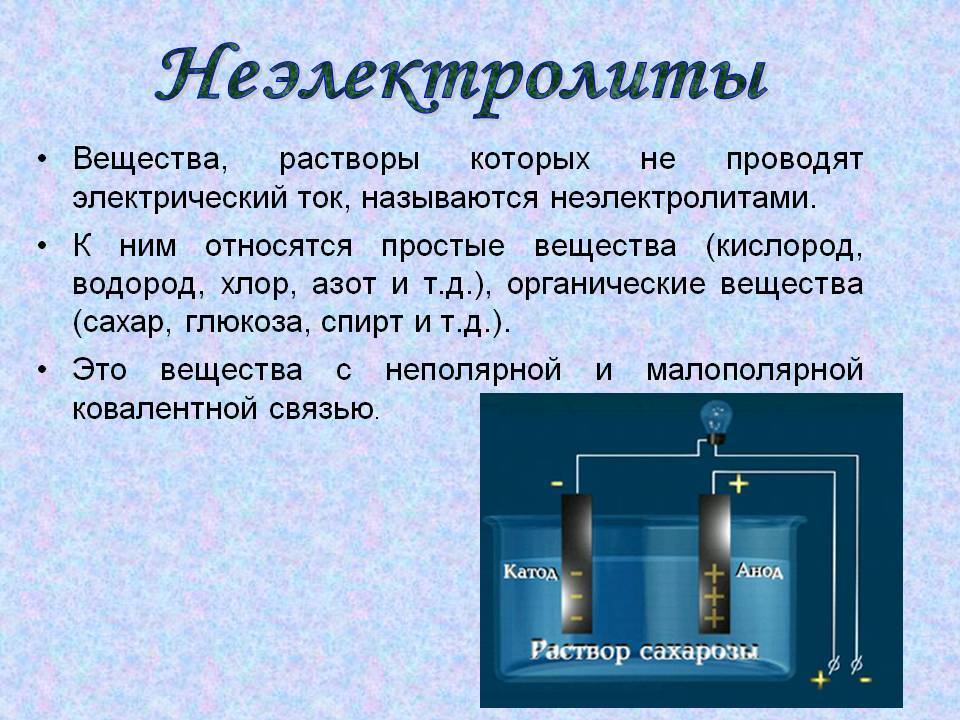
Всем известно, что металлы проводят электрическим ток. А проводят ли электрический ток растворы? Если бы мы попытались ответить на этот вопрос при помощи опыта, то убедились бы, что раствор сахара не проводит электрический ток, а раствор поваренной соли проводит. Почему? Может быть, исходные вещества — вода или сухой хлорид натрия — электропроводны? Но аналогичный опыт показывает — эти вещества, каждое само по себе, электрический ток проводить не могут.
Для того чтобы объяснить результаты этих опытов и понять смысл явления, необходимо ответить на вопрос: почему вообще некоторые вещества, например металлы, проводят электрический ток? Это происходит потому, что в металлах имеются «свободные» заряженные частицы — электроны. С направленным движением этих заряженных частиц связана электропроводность металлов. Таким образом, если раствор NаСl проводит электрический ток, то, значит, в этом растворе тоже образуются какие-то заряженные частицы. Если раствор сахара не проводит электрический ток, значит, в растворе сахара заряженных частиц не образуется. Исходя из этого, такие вещества называют:
- NаСl — электролит;
- Сахар — неэлектролит.
Итак: ЭЛЕКТРОЛИТЫ — это вещества, растворы (и расплавы) которых проводят электрический ток. А ПОЧЕМУ?
Устройство и принцип работы
Конденсатор — устройство, состоящее из двух пластин (обкладок), имеющих между собой пустоту. Напряжение к нему подаётся через проводки, подсоединённые к пластинкам. Современные приборы, по сути, не сильно отличаются от макетов на уроках физики, они также состоят из диэлектрика и обкладок. Следует отметить, что именно вещество или его отсутствие (вакуум), плохо проводящее электричество, изменяет характеристики накопителя.
Суть принципа работы конденсатора проста: дали напряжение, и заряд начал накапливаться. Для примера следует рассмотреть как ведёт себя накопитель в двух вариантах электрической цепи:
- Постоянный ток. Если в цепь с подключённым к ней конденсатором подать ток, то можно увидеть, что стрелка на амперметре начнёт двигаться, а потом быстро вернётся в исходное положение. Это объясняется просто: устройство быстро зарядилось, то есть источник питания был уравновешен обкладками накопителя, и тока не стало. Поэтому часто говорят, что в условиях постоянного тока конденсатор не работает. Такое утверждение неправильное, всё функционирует, но очень непродолжительное время.
- Переменный ток — это когда электроны двигаются сначала в одну, а затем в другую сторону. Если представить такую цепь с подключённым к ней накопителем, то на обеих обкладках конденсатора будут попеременно накапливаться положительные и отрицательные заряды. Это говорит о том, что переменный ток свободно протекает через устройство.

Полупроводники
Это особая группа веществ, которая проводит электрический ток при создании определенных условий. В кристаллической решетке полупроводников наблюдается крайне ограниченное наличие свободных носителей зарядов. Но при создании соответствующих условий, например, при воздействии света, понижении или повышении температуры, или каких-либо специфических факторов количество освобожденных носителей возрастает.

Вещества, которые проводят электрический ток и относятся к группе полупроводников обладают одной особенностью – под воздействием внешних факторов связанные электроны покидают свое место, и образуют т.н. «дырку». Она имеет положительный заряд. При создании электрического поля электроны и «дырки» двигаются навстречу друг другу, образуя электрический ток. Такая особенность называется электронно-дырочной проводимостью. Наиболее распространенными полупроводниками считаются кремний, германий, селен, галлий, теллур и т.д.
Ионно-молекулярные уравнения реакций
Из вышеизложенного следует, что в растворах большинства неорганических веществ, наряду с молекулами, находится значительное число ионов. В таком случае уравнения реакций, которые показывают состав молекул реагирующих веществ, весьма условны. Более точно отражают состав реагирующих частиц ионно-молекулярные уравнения.
Для того чтобы составить ионно-молекулярное уравнение реакции, нужно записать в виде ИОНОВ химические формулы:
- сильных и одновременно
- растворимых электролитов.
Состав всех остальных веществ изображается в виде молекул.
На практике, при составлении таких уравнений рекомендуется следовать следующему алгоритму:
1. Определить силу реагирующих электролитов:
2. Для сильных электролитов определить растворимость (по таблице растворимости):
3. Формулы сильных и одновременно растворимых электролитов записать в виде ионов, остальные формулы НЕ ИЗМЕНЯТЬ!
4. Одинаковые ионы «вычеркиваем», так как они не участвуют в реакции (не изменили ни состава, ни заряда), получаем краткое ионно-молекулярное уравнение:
Краткое ионно-молекулярное уравнение показывает:
- что реакция возможна;
- что в результате реакции образуется осадок (СuS);
- какие ионы или молекулы должны участвовать в аналогичном процессе.
Для того, чтобы переписать краткое ионно-молекулярное уравнение в молекулярном виде, необходимо вместо:
- ионов H+ написать формулу сильной кислоты;
- ионов ОH— написать формулу щёлочи;
- остальных ионов написать формулу растворимой соли.
Например, для того чтобы осуществить процесс:
вместо нитрата меди можно взять любую растворимую соль меди (II), так как она при электролитической диссоциации посылает в раствор ион меди, а анион соли в реакции не участвует:
Задание 6.7. Составьте молекулярные и ионно-молекулярные уравнения реакции для этих процессов и убедитесь, что краткие ионно-молекулярные уравнения реакций у них одинаковые.
Задание 6.8. Записать в молекулярном и молекулярно-ионном виде уравнения, соответствующие предложенным кратким молекулярно-ионным уравнениям:
При составлении ионно-молекулярных уравнений может получиться так, что все частицы будут вычеркнуты, так как не изменят ни состава, ни заряда. В этом случае говорят, что реакция в растворе не идёт. В принципе, можно заранее предсказать возможность такого процесса: реакция ионного обмена в растворе возможна, если происходит связывание ионов, т. е. образуется осадок, газ, слабый электролит или ион нового состава.
Задание 6.9. Составьте ионно-молекулярные уравнения реакций:
- фосфат натрия + хлорид кальция →
- карбонат бария + азотная кислота →
- гидроксид железа III + серная кислота →
- сульфат аммония + гидроксид калия →
- нитрат алюминия + хлорид натрия →
Сделайте заключение: возможны ли эти процессы. Укажите признаки возможных процессов (осадок, газ, слабый электролит).
Вывод: любая реакция ионного обмена протекает в сторону связывания ионов, поэтому в результате такой реакции образуется слабый электролит или осадок, или газ.

Применение электролиза
А теперь самое главное: зачем вообще нужен электролиз? Рассмотрим применение этого вида ОВР:
С помощью электролиза расплавов природных соединений в металлургической промышленности получают активные металлы (калий, натрий, бериллий, кальций, барий). С помощью электролиза растворов солей — цинк, кадмий, кобальт и другие.
В химической промышленности электролиз используют для получения фтора, хлора, водорода, кислорода, щелочей, бертолетовой соли и других веществ.
Электролиз с растворимым анодом используют для нанесения металлических покрытий (из хрома, золота, никеля, серебра), что предохраняет металлические изделия от коррозии и придает им декоративный вид.
Особенности электролиза растворов
В растворах электролитов, помимо самого вещества, присутствует вода. Под действием электрического тока водный раствор электролита разлагается.
Процессы, происходящие на катоде и аноде, различаются.
1. Процесс на катоде не зависит от материала, из которого он изготовлен. Однако, зависит от положения металлов в электрохимическом ряду напряжений.
2. Процесс на аноде зависит от материала, из которого состоит анод и от его природы.
а) Растворимый анод (Cu, Ag, Ni, Cd) подвергается Me => Men+ + ne
б)На не растворимом аноде (графит, платина) обычно окисляются анионы S-, J-, Br-, Cl-, OH- и молекулы H2O:
- 2J- => J2 + 2e;
- 4OH- => O2 + 2H2O + 4e;
- 2H2O => O2 + 4H+ + 4e
Рассмотрим примеры различных вариантов электролиза растворов:
1. Разложение бескислородной соли на нерастворимом электроде
Чтобы ознакомиться с этим вариантом электролиза, возьмем йодистый калий. Под действием тока ионы калия устремляются к катоду, а ионы йода к аноду.
KI → K+ + I-
Калий находится в диапазоне активности слева от алюминия, поэтому на катоде восстанавливаются молекулы воды и образуется атомарный водород.
Катод: 2H2O + 2e- → H2 + 2OH-
Процесс протекает на нерастворимом аноде и в состав соли входит бескислородный остаток, поэтому на аноде образуется йод.
Анод: 2I-— 2e- → I20
В результате можно создать общее уравнение электролиза:
2. Разложение бескислородной соли на растворимом электроде (медь)
Рассмотрим на примере хлорида натрия. Данная соль разлагается на ионы натрия и хлора, но следует учитывать материал анода. Медный анод сам подвергается окислению. На аноде выделяется чистая медь, и ионы меди переходят с анода на катод, где также осаждается медь. В итоге процесс можно представить следующими уравнениями реакций.
- NaCl → Na+ + Cl-
- Катод: Cu2+ + 2e- → Cu
- Анод: Cu — 2e- → Cu2+
В растворе концентрация хлорида натрия остается неизменной, поэтому составить общее уравнение реакции процесса не представляется возможным.
3. Разложение кислородосодержащей соли на нерастворимом (инертном) электроде
Возьмем для примера раствор нитрата калия. В процессе электролиза происходит распад на ионы калия и кислотного остатка.
KNO3 → K+ + NO3-
В ряду активности металлов калий находится левее алюминия, поэтому на катоде восстанавливаются молекулы воды и образуется газообразный водород.
Катод: 2H2O + 2e- → H2 + 2OH-
Молекулы воды окисляются на аноде и выделяется кислород.
Анод: 2H2O — 4e- → O2 + 4H+
В результате получаем общее уравнение электролиза:
2H2O → 2H2 + O2
4. Электролиз раствора щелочи на инертном электроде
В случае разложения щелочи в процесс электролиза включаются молекулы воды и гидроксид-ионы.
Ba(OH)2 → Ba2+ + 2OH-
Барий находится левее алюминия, поэтому на катоде происходит восстановление воды и выделение водорода.
Катод: 2H2O + 2e- → H2 + 2OH-
На аноде откладываются молекулы кислорода.
Анод: 4OH- — 4e- → O2 + 4H+
Получаем суммарное уравнение электролиза:
2H2O → 2H2 + O2
5. Электролиз раствора кислоты на инертном электроде
При разложении азотной кислоты под действием электрического тока в процесс вступают катионы водорода и молекула воды.
- HNO3 → H+ + NO3–
- Катод: 2H+ + 2e- → H2
- Анод: 2H2O — 4e- → O2 + 4H+
На катоде выделяется водород, на аноде – кислород. Получаем суммарное уравнение процесса:
2H2O → 2H2 + O2
Понятие о рН (водородном показателе)
Вода — очень слабый электролит: при обычных условиях лишь одна молекула воды из 10 000 000 распадается на ионы:
Это уравнение показывает, что при диссоциации 1 моль молекул воды образуется 1 моль ионов водорода Н+ и 1 моль гидроксид-анионов ОН–. Другими словами: в чистой воде концентрация ионов водорода равна концентрации гидроксид-анионов:
Здесь: — равновесная концентрация ионов водорода, моль/л; — равновесная концентрация гидроксид-анионов, моль/л.
Такой раствор (среда) называется «нейтральный».
Характер среды — кислый, нейтральный — можно оценить количественно при помощи рН («пэ-аш»). Водородный показатель рН равен логарифму концентрации ионов водорода, взятому с обратным знаком*:
Поэтому в случае чистой воды рН = 7.
Раствор, у которого рН = 7, называется нейтральным.
Если к чистой воде добавили кислоту, то увеличили концентрацию ионов водорода. Теперь эта концентрация составит, например 10–6 моль/л или 10–2 моль/л.
Такая среда (раствор) называется «кислая», или «кислотная». Причём в первом случае (рН = 6) среда считается слабокислой, а во втором (рН = 2) — сильнокислой, т. е. в любом случае рН < 7. Значение рН можно измерять и с большей точностью (например, рН = 5,36).
pН < 7, среда кислая.
При добавлении щёлочи увеличивается концентрация ионов ОН–, и одновременно уменьшается концентрация ионов Н+. Дело в том, что для любого водного раствора
Поэтому, если концентрация ионов ОН– составит 10–3, то = 10–11, т. е.
рН > 7, среда щелочная.
Определить реакцию среды конкретного раствора можно при помощи индикаторов.
Индикаторы — это вещества, которые изменяют свой цвет в присутствии избытка ионов Н+ или ОН–.
Ионы Н+ или ОН– действуют на молекулу индикатора, и индикатор меняет цвет по-разному в зависимости от реакции среды и вида самого индикатора (табл. 7).

Задание 6.10. Какую окраску будет иметь индикатор лакмус, если:
- рН < 7;
- = 10–4 моль/л;
- в растворе есть избыток ОН–;
- рН = 7;
- = 10–8 моль/л;
- в растворе есть НNО3;
- = 0,1 моль/л.
Окраска индикаторов изменяется в растворах, которые содержат избыток одного из этих ионов. Ионы Н+ или ОН– могут образовываться в ходе диссоциации некоторых соединений.
Вопрос. Какие вещества при диссоциации образуют ионы Н+ или ОН–?
Эти ионы могут образовываться при диссоциации растворимых кислот, оснований, некоторых кислых и основных солей. Например, дигидрофосфат натрия образует при диссоциации ионы водорода, а гидрофосфат натрия — нет. Дело в том, что кислые соли могут диссоциировать ступенчато, если полученный на первой стадии анион соответствует сильному электролиту:
остаток слабого электролита → диссоциация не идёт;
остаток сильного электролита → диссоциация идёт:
Образуются ионы Н+, возникает кислая среда.
Кроме того, ионы Н+ или ОН– могут образовываться в ходе взаимодействия некоторых веществ с водой. Например, с водой могут взаимодействовать активные металлы, кислотные и основные оксиды.
Задание 6.11. Какую окраску будет иметь индикатор лакмус, если в воде растворить: кальций, оксид лития, оксид серы (IV)?

Что такое сахар

С точки зрения химии сахар представляет собой дисахарид, формула которого — C12H22O11. Сахар состоит из молекулы сахарозы и молекулы фруктозы. Молекула сахара образуется за счет прочных ковалентных связей между атомами углерода, кислорода и водорода, что является важным моментом для понимания, почему не проводит электрический ток раствор сахара.
Говоря о физических свойствах сахара, следует отметить, что он обладает высокой растворимостью в воде. Так, при 20 °C в 100 г воды можно растворить 203,9 г сахара. При увеличении температуры воды этот показатель также растет, достигая значения 478,2 г при 100 °C. Водный раствор сахара называется сиропом.
Гидролиз солей
Попробуйте ответить на вопрос: изменится ли окраска лакмуса в растворе серной кислоты? гидроксида натрия? сульфата натрия? карбоната натрия? В первых двух случаях можно уверенно сказать «да», так как при диссоциации образуются:
ионы водорода (уравнение 1) или гидроксид-анионы (уравнение 2), а индикаторы реагируют именно на избыток ионов Н+ или ОН–. Но при диссоциации упомянутых солей:
ионы Н+ и ОН– не образуются! Тем не менее раствор карбоната натрия изменяет окраску индикатора, а сульфата натрия — нет! Почему? Видимо, причина в том, что ионы карбоната натрия вступают в какую-то реакцию с молекулами воды, ведь только из молекулы воды может образоваться избыток Н+ или ОН–.
Гидролиз солей — это процесс взаимодействия ионов соли с молекулами воды, в результате чего изменяется рН раствора.
Какой ион карбоната натрия реагирует с водой? Предположим, что оба. Тогда в растворе происходят процессы:
Вспомните, что такое «сильный электролит», «слабый электролит», и ответьте на вопрос: какой из этих процессов (А или Б) НЕВОЗМОЖЕН в растворе?
Очевидно, невозможен процесс (А), так как молекул сильного электролита NаОН в растворе НЕТ, есть только ионы Na+ и ОН–, другими словами, связывания ионов не происходит.
Следовательно, происходит процесс (Б), и краткое ионномолекулярное уравнение гидролиза карбоната натрия выглядит так:
pH > 7, среда щелочная, лакмус синий.
И действительно, в растворе карбоната натрия лакмус становится синим. Почему именно карбонат-анион вступает в реакцию гидролиза? Потому что это ион, соответствующий СЛАБОМУ электролиту и в результате его взаимодействия с водой образуется СЛАБЫЙ электролит (вспомните условия протекания ионных процессов).
Вывод. Гидролизу подвергаются соли, содержащие остаток слабого электролита.
Например:

Задание 6.12. Определите, происходит ли гидролиз в растворах хлорида железа (III), силиката натрия, нитрата калия. Ответ поясните.
Алгоритм составления уравнений реакции гидролиза:
1. Определить какие электролиты образуют соль, отметить их силу:
2. Составить уравнение диссоциации соли, подчеркнуть ион, соответствующий слабому электролиту:
3. Для иона слабого электролита составить уравнение реакции взаимодействия с одной молекулой воды (уравнение гидролиза):
- из молекулы воды притягивается противоположно заряженный нон, в данном случае ОН–;
- сумма зарядов до и после реакции равна:
4. Определить реакцию среды в образовавшемся растворе: в данном случае образовались ионы Н+, значит, среда кислая, рН< 7.
Вопрос. Какую окраску будет иметь лакмус в этом растворе?
5. Для того чтобы составить молекулярное уравнение реакции гидролиза, следует:
- дописать к каждому иону ионы, которые образуются при диссоциации, с противоположным зарядом (в данном случае ионы Cl–);
- составить полученные формулы по валентности (валентность = заряду иона!):
Задание 6.13. Составить уравнения реакций гидролиза для: сульфата алюминия; силиката калия; хлорида натрия; нитрата меди (II); сульфида калия.
Задание 6.14. Как при помощи лакмуса различить бесцветные растворы солей: нитрата свинца (II), сульфата калия, сульфида натрия?

1.15. Электрический ток в электролитах window.top.document.title = “1.15. Электрический ток в электролитах”;
Электролитами принято называть проводящие среды, в которых протекание сопровождается переносом вещества. Носителями свободных зарядов в электролитах являются положительно и отрицательно заряженные ионы. К электролитам относятся многие соединения металлов в расплавленном состоянии, а также некоторые твердые вещества. Однако основными представителями электролитов, широко используемыми в технике, являются водные растворы неорганических кислот, солей и оснований.
Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза.
Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы – к положительному электроду (аноду). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией. Например, хлорид меди CuCl2 диссоциирует в водном растворе на ионы меди и хлора:
Достигнув катода, ионы меди нейтрализуются избыточными электронами катода и превращаются в нейтральные атомы, оседающие на катоде. Ионы хлора, достигнув анода, отдают по одному электрону. После этого нейтральные атомы хлора соединяются попарно и образуют молекулы хлора Cl2. Хлор выделяется на аноде в виде пузырьков.
Во многих случаях электролиз сопровождается вторичными реакциями продуктов разложения, выделяющихся на электродах, с материалом электродов или растворителей. Примером может служить электролиз водного раствора сульфата меди CuSO4 (медный купорос) в том случае, когда электроды, опущенные в электролит, изготовлены из меди.
Диссоциация молекул сульфата меди происходит по схеме
4
Образовавшаяся молекула сульфата меди переходит в раствор.
Таким образом, при прохождении электрического тока через водный раствор сульфата меди происходит растворение медного анода и отложение меди на катоде. Концентрация раствора сульфата меди при этом не изменяется.
| Рисунок 1.15.1.Электролиз водного раствора хлорида меди |
Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе:
Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду Q, прошедшему через электролит:
Величину k называют электрохимическим эквивалентом.
Масса выделившегося на электроде вещества равна массе всех ионов, пришедших к электроду:
Здесь m и q – масса и заряд одного иона, – число ионов, пришедших к электроду при прохождении через электролит заряда Q. Таким образом, электрохимический эквивалент k равен отношению массы m иона данного вещества к его заряду q.
Так как заряд иона равен произведению валентности вещества n на элементарный заряд e (q = ne), то выражение для электрохимического эквивалента k можно записать в виде
Здесь NA – постоянная Авогадро, M = mNA – молярная масса вещества, F = eNA – постоянная Фарадея.
Постоянная Фарадея численно равна заряду, который необходимо пропустить через электролит для выделения на электроде одного моля одновалентного вещества.
Закон Фарадея для электролиза приобретает вид:
Явление электролиза широко применяется в современном промышленном производстве.
Удельное сопротивление
Способность лучше или хуже проводить ток определяется удельным сопротивлением — ⍴ (ро). Вот удельные сопротивления некоторых металлов, применяемых в электротехнике.
| Металл | Удельное сопротивление при 20°С, х10-8 Ом∙м |
| Серебро | 1,6 |
| Медь | 1,7 |
| Золото | 2,3 |
| Алюминий | 2,8 |
| Вольфрам | 5,5 |
| Сталь | 12 |
| Нихром | 110 |
Удельное сопротивление зависит от температуры. Чем она ниже, тем сопротивление меньше. Объясняется это тем, что с уменьшением температуры электроны меньше совершают хаотичных движений и меньше сталкиваются. При температуре абсолютного нуля (-273˚С) движение прекращается. У большинства материалов при этом способность проводить ток резко исчезает, но у некоторых возникает явление сверхпроводимости, когда удельное сопротивление равно нулю. При этом величина тока в проводнике ничем не ограничивается.
Что такое хлорид натрия

Хлорид натрия или столовая соль представляет собой вещество, химическая формула которого — NaCl. В природе хлорид натрия присутствует в форме минерала галита. В твердом состоянии NaCl представляет собой ионный кристалл, образованный анионами Cl- и катионами Na+, которые находятся в узлах кристаллической решетки. Каждый ион в решетке окружен шестью ионами, имеющими противоположный знак и расположенными в вершинах октаэдра.
У хлорида натрия кристаллическая решетка является сложной. Ее можно представить как две гранецентрированные кубические решетки (одна образована катионами Na+, а другая анионами Cl-), вставленные друг в друга.
Для понимания ответа на вопрос о том, почему раствор сахара электрический ток не проводит, а раствор хлорида натрия проводит, также важно знать, что поваренная соль отлично растворяется в воде
Способность различных веществ проводить электрический ток
Если не принимать во внимание физическое состояние, то все материалы можно условно разделить на три группы по степени проводимости электричества:
Рассмотрим каждый случай более подробно.

Проводники
К этой группе можно отнести вещества, которые проводят электрический ток великолепно. Это – металлы, электролиты и ионизированные газы.

Металлы как проводники электрического тока

Первая подгруппа веществ имеет кристаллическую решетку и отличается большим наличием свободных электронов, которые и являются носителями заряда при создании соответствующих условий, в частности электрического поля. Их расплавы проводят электрический ток не хуже, чем в твердой фазе. Не стоит забывать, что металлы могут быть и в жидком состоянии, примером чего является ртуть. Но наибольшее распространение, в качестве проводников, получили твердые фазы этих веществ. При взаимодействии с кислородом металл образуют оксиды, которые проводят электрический ток только при определенных условиях и по своей сути являются полупроводниками. Речь о них пойдет ниже. Из металлов отличной электропроводностью обладают медь, алюминий, железо, серебро и др.
Жидкие проводники электрического тока

Под жидкими проводниками понимают кислоты, растворы, электролиты, которые проводят электрический ток. Носителем заряда в данных случаях являются ионы. Необходимо отметить, распространенное убеждение что вода является проводником, в корне неверно. Когда Н2О находиться в чистом состоянии, свободные ионы в ней отсутствуют. Если при помещении в воду электродов наблюдается протекание электрического тока, то это говорит только о том, что в данном случае мы имеем дело с раствором какого-либо вещества.